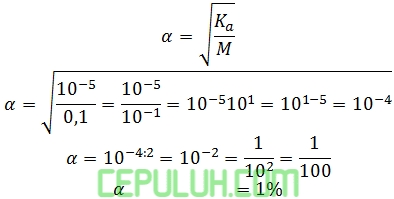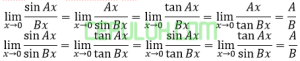(1). Soal PG Pembahasan 2 Stoikiometri Titrasi Asam Basa
Sebanyak 200 cm3 larutan kalium iodida 1 M dicampurkan dengan 50 cm3 larutan timbal (II) nitrat 1 M sehingga terjadi reaksi:
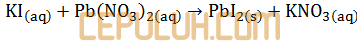
Jumlah mol pereaksi yang berlebihan setelah berlangsungnya reaksi adalah ….
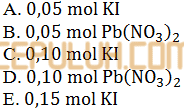
Jawaban: C Pembahasan:
Reaksi belum setara, banyak atom tiap unsur di kiri-kanan panah belum sama. Setarakan menjadi:
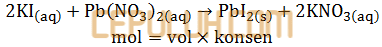
mol kalium iodida mol KI=200 cm3×1 M=200 mmol.
mol timbal II nitrat mol PbNO32=50 cm3×1 M=50 mmol.

Sisa mol KI=100 mmol= 100/1000 mol=0,10 mol.
(2). Urea Basa Lemah Dititrasi Larutan HCl
21. Urea, (NH2)2CO, adalah basa lemah dengan Kb = 1,5×10-14. Sebanyak 25 ml larutan urea 0,01 M dititrasi dengan larutan HCl 0,01 M. Pernyataan yang benar untuk larutan hasil titrasi setelah penambahan 10 ml HCl adalah …
A. [H3O+] = [OH]
B. Jumlah ion Cl– > 0,10 mol
C. Rasio [(NH2)2CO] / [NH2CONH3+] = 1
D. [OH–] = [NH2CONH3+]
E. Terbentuk larutan buffer
21. Pembahasan:
Campuran (NH2)2CO dan HCl merupakan campuran yang terdiri dari basa lemah dan asam kuat

Pernyataan yang benar untuk larutan hasil titrasi adalah terbentuk larutan buffer.
Jawaban: E
(3). Soal PG Pembahasan Stoikiometri Titrasi Asam Basa
Soal PG Pembahasan 1 Stoikiometri Titrasi Asam Basa
untuk membuat 4 gram besi (III) sulfat (Mr=400) dari besi (III) oksida diperlukan larutan asam sulfat 0,1 M sebanyak ….ml.
Jawab: D Pembahasan:
Besi (III) sulfat artinya biloks (muatan) besi ini (3).
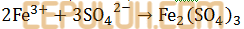
Besi (III) oksida,
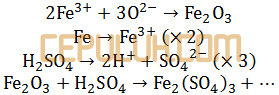
Belum setara, banyak atom tiap unsur kiri-kanan panah sama.
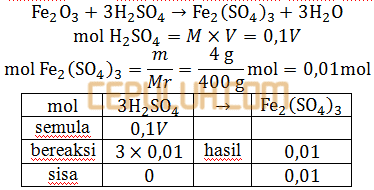
mmol H2SO4 semula dikurangi bereaksi sama dengan nol.
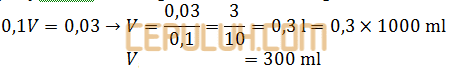
(4). Menetralkan Konsentrasi Larutan HCl Dititrasi dengan Baoh
28. untuk menetralkan konsentrasi larutan HCl, diambil 20 ml larutan tersebut kemudian dititrasi dengan larutan Ba(OH)2 0,1 M. Data titrasi yang diperoleh sebagai berikut:
| Percobaan | Volume larutan HCl | Volume larutan Ba(OH)2 |
|---|---|---|
| 1 | 20 ml | 12 ml |
| 2 | 20 ml | 13 ml |
| 3 | 20 ml | 14 ml |
Berdasarkan data tersebut, konsentrasi HCl sebesar …
A. 0,060 M D. 0,130 M
B. 0,065 M E. 0,200 M
C. 0,070 M
28. Pembahasan:
pada titrasi asam basa berlaku rumus:
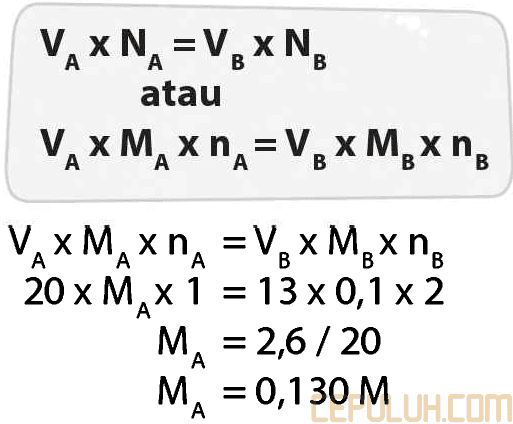
Jawaban: D
(5). Volume Larutan yang Dititrasi Maka Konsentrasi Larutan Asam Hx
27. Perhatikan grafik titrasi asam basa berikut!
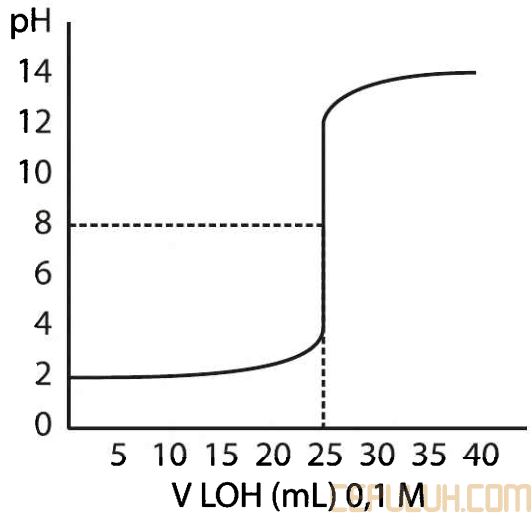
Jika volume larutan yang dititrasi sebanyak 20 ml maka konsentrasi larutan asam HX tersebut adalah …
A. 0,080 M D. 0,815 M
B. 0,100 M E. 1,250 M
C. 0,125 M
27. Pembahasan:
pada kurva titrasi, volume asam/basa yang digunakan adalah volume pada saat titik ekuivalen berlangsung.
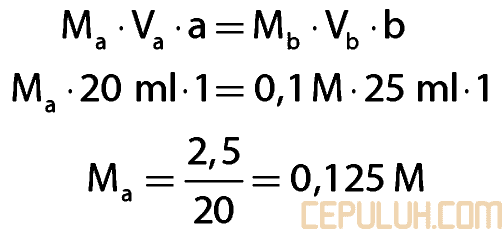
Jawaban: C
(6). Soal PG Pembahasan 6 Stoikiometri Titrasi Asam Basa
Magnesium hidroksida Mg(OH)2 dapat larut dalam asam sulfat H2SO4. Jika berat magnesium sulfat yang terbentuk sebanyak 2,4 gram (Ar Mg=24,S=32,O=16,H=1) maka berat magnesium hidroksida yang larut adalah …gram.
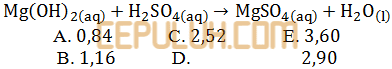
Jawab: B Pembahasan:
Persamaan reaksi di atas sudah setara, banyak atom tiap unsur di kiri-kanan sama. Perbandingan koefisien sama dengan perbandingan mol.
Mr magnesium sulfat Mr=Ar(Mg+S+4×O)
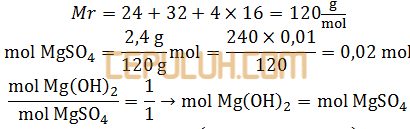
Mr magnesium hidroksida Mr=Ar(Mg+2×(O+H) )
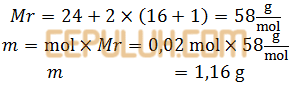
(7). Soal PG Pembahasan 4 Stoikiometri Titrasi Asam Basa
Logam magnesium sebanyak 6 gram dimasukkan ke dalam larutan asam klorida secukupnya. (Ar Mg=24). Bila persamaan reaksi yang terjadi:
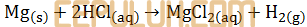
Volume gas hidrogen yang terjadi pada keadaan standar adalah … liter.
Jawab: A Pembahasan:
pada keadaan standar setara banyak gas 1 mol≡22,4 liter.
Persamaan reaksi di atas sudah setara, banyak atom tiap unsur di kiri-kanan sama. Perbandingan koefisien sama dengan perbandingan mol.
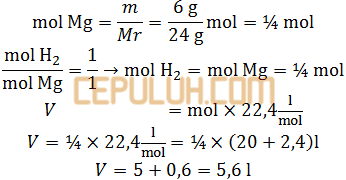
(8). Titrasi Larutan HCl dengan Larutan NaOH
26. Berikut data hasil titrasi larutan HCl dengan larutan NaOH 0,1 M.
| Percobaan | Volume HCl yang digunakan | Volume NaOH yang digunakan |
|---|---|---|
| 1 | 20 ml | 15 ml |
| 2 | 20 ml | 14 ml |
| 3 | 20 ml | 16 ml |
Berdasarkan data tersebut, konsentrasi larutan HCl adalah …
A. 0,070 M D. 0,133 M
B. 0,075 M E. 0,143 M
C. 0,080 M
26. Pembahasan:
Rumus titrasi asam-basa:

Jawaban: B
(9). Etilamina Dititrasi dengan HCl
23. Sebanyak 25 ml etilamina, C2H5NH2, 0,1 M (Kb = 5,6×104) dititrasi dengan HCl 0,1 M. Pernyataan yang benar untuk larutan hasil titrasi setelah penambahan 10 ml HCl adalah …
A. [H3O+] < 10-7
B. terbentuk larutan buffer yang bersifat asam
C. [C2H5NH2] > [C2H5NH3+]
D. [OH–] = [C2H5NH3+]
E. jumlah ion Cl– < 1,0 mol
23. Pembahasan:
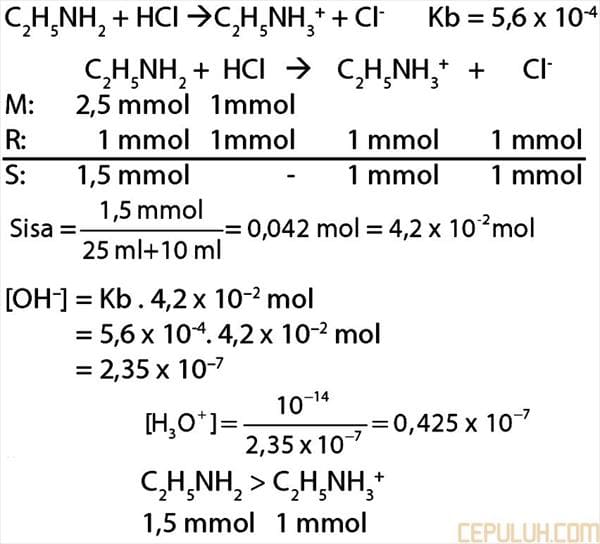
Jawaban: C
(10). Soal PG Pembahasan 10 Stoikiometri Titrasi Asam Basa
Larutan HCl yang belum diketahui konsentrasinya, dititrasi dengan larutan NaOH 0,1 M menggunakan indikator pp. Berdasarkan hasil titrasi diperoleh data sebagai berikut:

Maka konsentrasi HCl adalah ….M.
Jawaban: E pembahasan:
Dititrasi artinya direaksikan sampai tak bersisa.
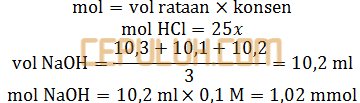
Perbandingan mol sama dengan perbandingan koefisien.
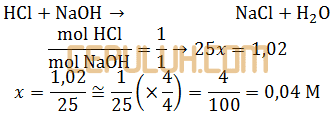
Larutan Asam-Basa # Bronsted Lowry Konjugasi Donor Akseptor
Larutan Penyangga Buffer Sisa Asam Lemah dan Garamnya
Larutan Asam-Basa # Titrasi Asam Basa