(1). pH Larutan Penyangga Buffer Campuran Asam Basa Lemah dan Garam
Dalam 50 ml larutan NH4OH 0,2 M terdapat 5,35 gram garam NH4Cl(Mr=53,5) dengan Kb=10-5, maka ….
(1). pH larutan = 8
(2). pH larutan yang terjadi tidak berubah walaupun ditambah dengan sedikit asam kuat
(3). pH larutan yang terjadi tidak berubah walaupun ditambah dengan sedikit basa kuat
(4). Bila diencerkan pH larutan selalu tetap
pernyataan yang benar adalah ….
Jawab: bahas:
Basa lemah dan garam asam membentuk buffer, larutan penyangga basa.

(1) benar.
Karena ini buffer maka penambahan sedikit asam atau basa tidak merubah pH. (2) dan (3) benar.
Pengenceran dengan banyak air bisa merubah pH menjadi pH=7.
(4) salah.
(2). Garam Amonium Sulfat Dilarutkan Dalam Air Hingga Volume ml Maka pH
47. Amonium sulfat (NH4)2SO4 adalah garam yang dibuat dari campuran NH4OH dan H2SO4. Jika 13,2 gram (NH4)2SO4 (Mr = 132) dilarutkan dalam air hingga volume menjadi 500 ml maka pH larutan yang dihasilkan adalah …
(diketahui: Kb NH3 = 10-5, Ar H = 1, O = 16, S = 32)
A. 2 – log 5 D. 9 + log 2
B. 4 – log 2 E. 10 + log 5
C. 5 – log 2
47. Pembahasan:
Rumus hidrolisis garam yang bersifat asam:

Jawaban: C
(3). pH Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Sebanyak 20 ml larutan NH3 0,3 M dengan Kb=10-5 dicampur dengan 40 ml larutan HClO3 0,1 M maka pH campuran yang terjadi adalah ….
Jawab: E bahas:
Basa lemah berlebih bereakasi dengan asam kuat, asam kuat secukupnya menghasilkan larutan penyangga basa.
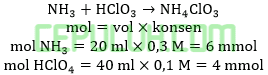
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.

Berhati-hati!
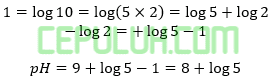
(4). pH Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Jika sebanyak 100 ml larutan amonium hidroksida 0,5 M dicampur dengan 100 ml asam sulfat 0,1 M maka pH yang terbentuk adalah …. (Kb=10-5)
Jawab: E bahas:
Ammonium hidroksida berlebih bereaksi dengan asam sulfat secukupnya menghasilkan buffer basa.
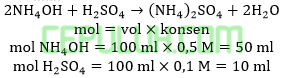
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.
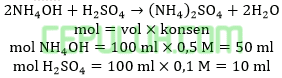
(5). Perbandingan Volume Reaksi Asam Basa Lemah dan Kuat Larutan Penyangga Buffer
Perbandingan volume HNO3 0,1M dengan NH4OH 0,1M bila larutan buffer yang terjadi memiliki pH=8 dan Kb=1,5×10-6 adalah ….
Jawab: B bahas:
Asam sulfat habis bereaksi dengan amonia berlebih menghasilkan buffer basa.
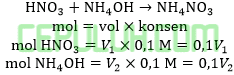
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.
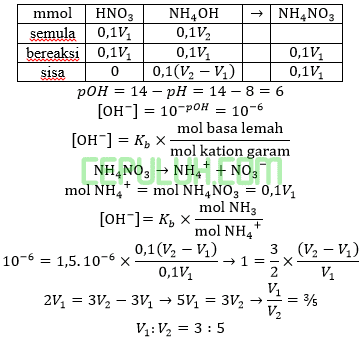
(6). pH Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Sebanyak 100 ml larutan NH4OH 0,1 M dicampur dengan 50 ml larutan HCl 0,1 M, jika Kb=10-5 maka pH larutan yang terjadi adalah ….
A. 12 B. 10 C. 9 D. 8 E. 5
Jawab: C bahas:
Basa lemah berlebih bereakasi dengan asam kuat, asam kuat habis menghasilkan larutan peyangga basa.
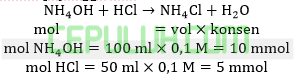
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.

(7). pH Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Ke dalam 90 ml larutan NH4OH 0,1 M, Kb NH4OH=10-5 dicampurkan dengan 15 ml larutan H2SO4 0,1M. Maka pH larutan yang terjadi adalah ….
Jawab: D bahas:
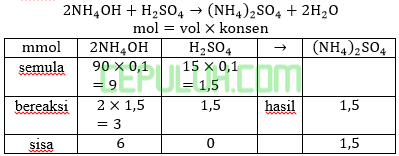
Basa kuat habis, sisa basa lemah dan garam (asam konjugasi)nya, ini larutan penyangga.

(8). Konsentrasi Mol Massa Diket pH Larutan Penyangga Reaksi Asam Basa
Jika 150 ml larutan NH3 0,1M (Kb=10-6) dicampur dengan 100 ml larutan asam sulfat. Agar pH buffer= 8-log2 maka konsentrasi larutan asam sulfat sebesar …M.
Jawab: A bahas:
amonia berlebih bereaksi dengan asam sulfat secukupnya menghasilkan buffer basa.

Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.
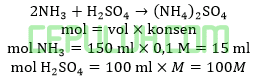
(9). Konsentrasi Mol Massa Diket pH Larutan Penyangga Reaksi Asam Basa
Agar terjadi larutan buffer dengan pH=9 maka 100 ml larutan HCl 0,1 M harus dicampur dengan larutan NH4OH 0,2 M sebanyak … ml.(Kb=10-5)
Jawab: A bahas:
Larutan buffer basa dapat hasil reaksi asam kuat habis dengan basa lemah berlebih.
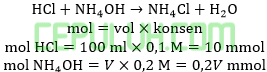
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.

(10). Larutan Penyangga Buffer Campuran Asam Basa Lemah dan Garam
Campuran yang dapat menghasilkan larutan buffer dengan pH>7 adalah ….
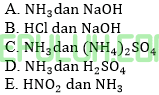
Jawab: C pembahasan:
Buffer basa memiliki pH>7 yaitu campuran basa lemah dan (asam konjugasi)nya. Garamnya bersifat asam karena terdiri anion (-) kuat dan kation (+) lemah.
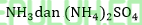
Larutan Penyangga Buffer Sisa Asam Lemah dan Garamnya
Larutan Asam-Basa # Titrasi Asam Basa





