(1). Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Campuran larutan dibawah ini yang membentuk larutan penyangga adalah ….

Jawab: D pembahasan:
Tidak bereaksi kimia karena sesama basa.
Larutan penyangga sisa asam lemah dengan garam (basa konjugasi)nya. Basa kuat habis.
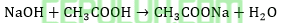
Supaya basa kuat NaOH habis maka mol NaOH lebih kecil dari CH3COOH.
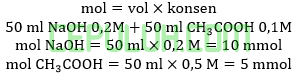
Ini bukan membentuk larutan penyangga.karena mol basa kuat lebih banyak dari asam lemah.
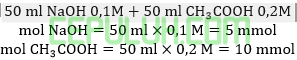
Ini membentuk larutan penyangga. karena mol basa kuat lebih sedikit dari asam lemah.
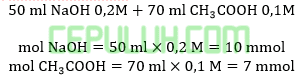
Ini bukan membentuk larutan penyangga.
(2). Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Campuran larutan dibawah ini yang menghasilkan larutan penyangga dengan harga pH kurang dari 7 adalah ….

Jawab: A pembahasan:
Itu ciri buffer, larutan penyangga asam yaitu hasil reaksi asam lemah berlebih dengan basa kuat lalu bersisa asam lemah dengan garamnya.
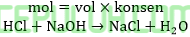
Ini bukan buffer, tetapi larutan garam netral karena hasil reaksi asam kuat dengan basa kuat.
Ini adalah buffer, larutan penyangga karena sisa asam lemah dan garamnya (basa konjugasi). pH < 7, pH kurang dari 7.
Ini bukan buffer karena sisa basa kuat dan garam.
(3). Garam NaNO2 Dilarutkan Ke Air Larutan Buffer Konsentrasi HNO2
32. Sebanyak 1 mol garam NaNO2 dilarutkan ke dalam 100 ml larutan buffer pH = 8. Konsentrasi HNO2 (Kb = 5,0×10-5) dalam larutan tersebut adalah …
A. 2×10-10M D. 5×10-5M
B. 2×10-7M E. 7×10-6M
C. 2×10-6M
32. Pembahasan:
Buffer dengan pH = 8 ➔ terdiri basa lemah dan asam konjugasinya (misal: NH3 dan NH4+).
Jika ditambahkan NaNO2 ditambahkan ke dalam larutan buffer tersebut maka akan bereaksi dengan asam konjugasi dari larutan buffer. Hal ini dikarenakan NaNO2 bersifat basa. Penambahan garam ini relatif tidak mengubah harga pH larutan buffer tersebut.

Jawaban: D
(4). Konsentrasi Mol Massa Diket pH Larutan Penyangga Reaksi Asam Basa
Ke dalam 1 liter larutan asam asetat 0,2 M dimasukkan sejumlah NaOH padat hingga pH=5. Jika perubahan volume larutan diabaikan serta harga tetapan ionisasiasam asetat Ka=1×10-5maka jumlah NaOH(Mr=40 g/mol) yang dimasukkan ke dalam larutan adalah ….g.
Jawab: E bahas:
Asam lemah direaksikan dengan basa kuat hasilnya pH < 7 berarti hasilnya adalah larutan penyangga yaitu campuran sisa asam lemah dengan garamnya.
Mol asam asetat semula:
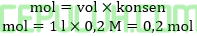
Mol NaOH semula:
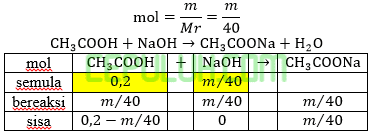
Larutan penyangga:

(5). Perbandingan Volume Reaksi Asam Basa Lemah dan Kuat Larutan Penyangga Buffer
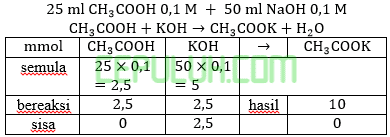
Perbandingan volume antara larutan CH3COOH 0,1M (Ka=10-5) dan larutan NaOH 0,1 M yang harus dicampurkan agar larutan buffer yang terbentuk memiliki pH=6 adalah ….
Jawab: E bahas:
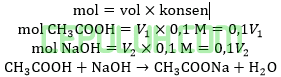
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.

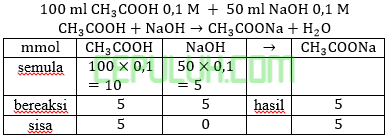
Volume CH3COOH dibutuhkan V1=100 ml. Volume NaOH dibutuhkan V2=50 ml.
(6). Perbandingan Volume Reaksi Asam Basa Lemah dan Kuat Larutan Penyangga Buffer
Larutan penyangga dengan pH=5 dapat dibentuk dari larutan CH3COOH 0,1M (Ka=10-5) dengan NaOH 0,1M. Volume CH3COOH dan NaOH 0,1M diperlukan … ml.
Jawab: B bahas:
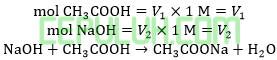
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.
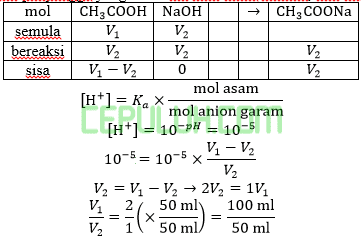
Volume CH3COOH dibutuhkan V1=100 ml. Volume NaOH dibutuhkan V2=50 ml.
(7). pH Larutan Penyangga Buffer Reaksi Asam Basa Lemah dan Kuat
Grafik berikut ini merupakan grafik titrasi larutan CH3COOH 0,2M (Ka=1×10-5) dengan larutan NaOH 0,2M. pada saat larutan NaOH yang ditambahkan mencapai setengah dari volume larutan CH3COOH maka pH larutan ditunjukkan oleh titik ….
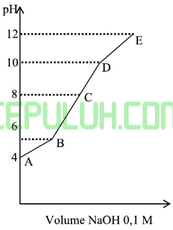
A. A B. B C. C D. D E. E
Jawab: B bahas:
Volume tidak diketahui, tapi
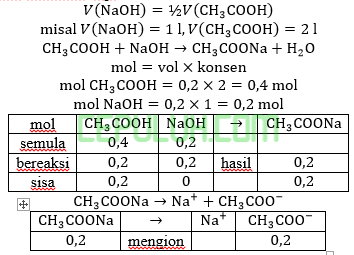
Terjadi larutan penyangga basa karena titrasi asam lemah oleh basa kuat.
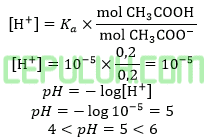
(8). Konsentrasi Mol Massa Diket pH Larutan Penyangga Reaksi Asam Basa
100 ml larutan Ca(OH)2 0,1 M dicampurkan ke dalam larutan CH3COOH 0,1 M, ternyata campuran ini pH=5. Jika harga (Ka asam asetat=10-5) maka volum larutan CH3COOH 0,1 M adalah ….ml.
Jawab: E bahas:
Basa kuat direaksikan dengan asam lemah menghasilkan larutan penyangga asam, jika pH < 7 atau larutan hidrolisis parsial garam bersifat basa , jika pH > 7.
pH=5 artinya reaksi ini menghasilkan buffer, larutan penyangga sisa asam lemah dan garam (basa konjugasi)nya, basa kuat habis.

(9). Konsentrasi Mol Massa Diketahui pH Larutan Penyangga Campuran Asam Basa Lemah dan Garam
Suatu larutan terdiri dari asam lemah HA dengan garam natriumnya (NaA) konsentrasi asam HA dalam larutan itu adalah 0,2 M, maka konsentrasi larutan NaA, agar mendapat campuran pH=5 adalah … M. (Ka=10-5 )
Jawab: C bahas:
Campuran asam lemah dengan garamnya membentuk larutan penyangga asam.

(10). Perbandingan Volume Reaksi Asam Basa Lemah dan Kuat Larutan Penyangga Buffer
Perbandingan volume NaOH 1M dan CH3COOH 1M yang diperlukan agar terjadi larutan buffer dengan pH=5 (Ka=10-5)adalah ….
Jawab: B bahas:
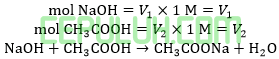
Ingat larutan penyangga yang mana zat kuat habis beraksi, sisa zat lemah.







