(1). Faktor-Faktor yang dapat Memengaruhi Pergeseran Kesetimbangan
27. Reaksi N2O4(g) ⇌ 2NO2(g) merupakan reaksi endotermis.
Pernyataan yang BENAR terkait reaksi tersebut adalah …
1) Penambahan N2O4 akan menyebabkan kesetimbangan bergeser ke kanan
2) Jika tekanan sistem diturunkan, kesetimbangan bergeser ke kanan
3) Kenaikan temperatur menyebabkan jumlah NO2 pada kesetimbangan meningkat
4) Penambahan katalis ke dalam sistem tidak mempengaruhi jumlah NO2 pada kesetimbangan
27. Pembahasan:
| Faktor-faktor yang dapat memengaruhi pergeseran kesetimbangan: • Tekanan dan volume: jika tekanan diperbesar (volume diperkecil) maka kesetimbangan bergeser ke arah mol kecil (koefisien kecil) dan jika tekanan diperkecil (volume diperbesar) kesetimbangan bergeser ke arah mol besar (koefisien besar.) • Suhu: jika suhu dinaikkan maka kesetimbangan bergeser ke arah reaksi yang menyerap kalor (endoterm, ΔH positif) dan jika suhu diturunkan kesetimbangan bergeser ke arah reaksi eksoterm, (ΔH negatif). • Konsentrasi: jika konsentrasi suatu zat ditambah maka kesetimbangan akan bergeser ke arah yang berlawanan dan jika konsentrasi suatu zat dikurangi maka kesetimbangan bergeser ke arah zat yang dikurangi. |
untuk reaksi: N2O4(g) ⇄ 2NO2(g) ΔH = + maka:
• Penambahan N2O4 reaksi bergeser ke kanan.
• Tekanan diturunkan kesetimbangan bergeser ke koefisien besar (ke kanan).
• Suhu diperbesar kesetimbangan bergeser ke endoterm (ke kanan) sehingga NO2 bertambah.
• Penambahan katalis hanya mempercepat tercapainya kesetimbangan.
Jawaban: A
(2). Pergeseran Kesetimbangan Jika Volumenya Diperkecil dan Suhunya Tetap
Diketahui reaksi kesetimbangan:
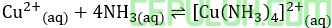
Jika volumenya diperkecil, sedangkan suhunya tetap, reaksi akan mengalami pergeseran kesetimbangan apabila terjadi perubahan jumlah ion, yaitu ….
A. Cu2+ bertambah, Kc bertambah, warna [Cu(NH3)4]2+ pekat
B. Cu2+ bertambah, Kc berkurang, warna [Cu(NH3)4]2+ pekat
C. Cu2+ berkurang, Kc bertambah, warna [Cu(NH3)4]2+ pudar
D. Cu2+ berkurang, Kc tetap, warna [Cu(NH3)4]2+ pekat
E. Cu2+ berkurang, Kc berkurang, warna [Cu(NH3)4]2+ pudar
Jawab: D Bahas:
Volume diperkecil maka tekanan membesar kesetimbangan ke arah jumlah koefisien lebih sedikit antara kiri-kanan anak panah.

Kesetimbangan bergeser ke kanan. Ion Cu2+ berkurang, warna [Cu(NH3)4]2+ pekat (bertambah).
(3). Pergeseran Kesetimbangan
28. Kesetimbangan terhadap asam format, karbon monoksida dan uap air pada 400°C memiliki Kp = 2·106
Pernyataan berikut yang benar untuk kesetimbangan tersebut adalah …
(1) Hampir seluruh asam format akan terurai jika dipanaskan pada 400°C.
(2) Asam format praktis tidak dapat dibuat dengan memanaskan campuran H2O dan CO pada 400°C.
(3) Asam format tidak stabil terhadap pemanasan.
(4) Laju reaksi penguraian asam format dapat diamati dengan mengukur perubahan tekanan dalam wadah.
28. Pembahasan:
Reaksi: HCHO2(g) ⇄ CO(g) + H2O(g)
Kp = 2·106 pada 400°C
Pernyataan yang benar:
(1) Hampir seluruh asam format akan terurai jika dipanaskan pada 400°C.
(2) Asam format praktis tidak dapat dibuat dengan memanaskan campuran H2O dan CO pada suhu 400°C ➜ karena pada suhu tersebut asam format akan terurai kembali.
(3) Asam sulfat tidak stabil terhadap pemanasan ➜ pemanasan (suhu dinaikkan) menyebabkan pergeseran kesetimbangan.
(4) Laju reaksi penguraian asam format dapat diamati dengan mengukur perubahan tekanan dalam wadah.
Jawaban: E
(4). Gambar Partikel pada Keadaan Kesetimbangan Mula
33. Berikut ini reaksi kesetimbangan.
Gambar partikel pada keadaan kesetimbangan mula-mula adalah sebagai berikut:
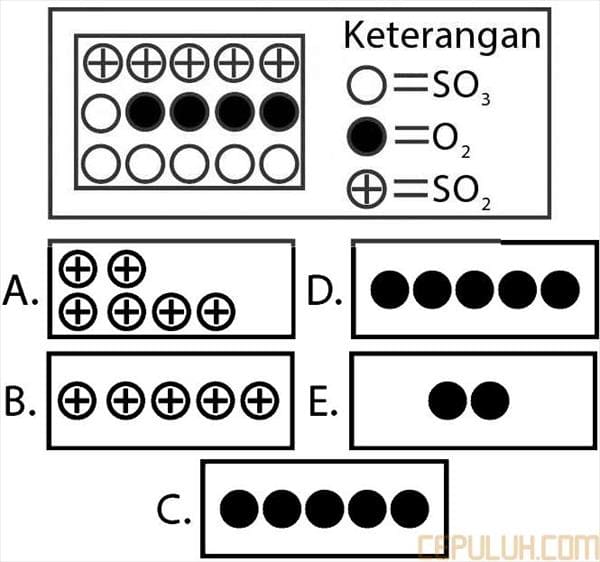
Jika tekanan diperbesar maka gambar partikel pereaksi kesetimbangan sesaat yang baru adalah …
33. Pembahasan:
Asas Le Chatelier menyatakan bila terhadap suatu kesetimbangan dilakukan suatu aksi maka sistem akan mengadakan reaksi.
Ingat! Cling
| • Tekanan diperbesar (volume diperkecil), kesetimbangan bergeser ke arah jumlah koefisien terkecil. • Tekanan diperkecil (volume diperbesar), kesetimbangan bergeser ke arah jumlah koefisien terbesar. |
Jumlah koefisien reaktan > peraksi. Jika tekanan diperbesar maka kesetimbangan bergeser ke arah koefisien terkecil (ke arah kanan). Hal ini menyebabkan pereaksi akan berkurang jumlahnya dan produkakan bertambah.
Jawaban: E
(5). Reaksi Kesetimbangan Bergeser
38. Diketahui reaksi kesetimbangan:
2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH = -45 kkal
Apabila pada volume tetap suhu dinaikkan maka kesetimbangan bergeser kearah …
A. ke kanan dan harga K tetap
B. kiri dan harga K makin kecil
C. kanan dan harga K makin kecil
D. kiri dan harga K makin besar
E. kanan dan harga K makin besar
38. Pembahasan:
Salah satu faktor yang memengaruhi pergeseran kesetimbangan adalah suhu. Jika suhu dinaikkan maka kesetimbangan bergeser ke arah reaksi yang menyerap kalor (endoterm, ΔH positif) dan jika suhu diturunkan maka kesetimbangan bergeser ke arah reaksi eksoterm (ΔH negatif).
Ingat!
| Nilai K hanya dipengaruhi suhu: • Endoterm : suhu naik, K meningkat • Eksoterm : suhu naik, K menurun |
untuk reaksi kesetimbangan:
Reaksi bersifat eksoterm maka kenaikan suhu menyebabkan kesetimbangan bergeser ke kiri dan nilai K semakin kecil.
Jawaban: B
(6). Pasangan Reaksi Kesetimbangan Hasil Lebih Banyak Jika Volume Diperbesar
35. Perhatikan data reaksi kesetimbangan di bawah ini!
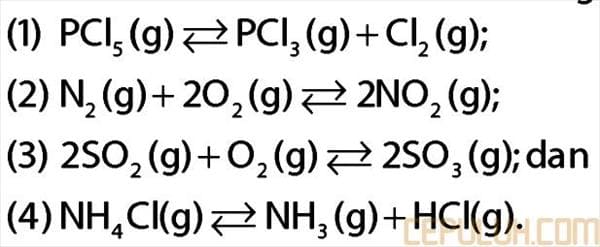
Pasangan reaksi kesetimbangan yang menghasilkan hasil lebih banyak jika volume diperbesar adalah
A. (1) dan (2) D. (2) dan (4)
B. (1) dan (4) E. (3) dan (4)
C. (2) dan (3)
35. Pembahasan:

Apabila ingin dihasilkan hasil/produk yang lebih banyak (reaksi bergeser ke kanan) apabila volume diperbesar, maka jumlah koefisien produk harus lebih besar dibanding koefisien reaktan.
Jawaban: B
(7). Reaksi Kesetimbangan Hujan Asam
21. Hujan asam dapat terjadi dari reaksi kesetimbangan berikut:
Pernyataan berikut yang benar adalah:
1) Reaksi pembentukan SO3 disertai dengan pelepasan kalor
2) Harga Kp = Kc
3) Tekanan diperbesar, produk SO3 bertambah
4) Suhu ditingkatkan, kesetimbangan bergeser ke arah produk SO3
21.Pembahasan:
2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH = -197,8 kJ
• Reaksi di atas merupakan reaksi pembentukan SO3 dan terjadi secara eksoterm (pelepasan kalor).
• Σkoefisien kiri ≠ Σkoefisien kanan sehingga Kp ≠ Kc.
• Bila tekanan diperbesar maka reaksi akan bergeser ke arah jumlah koefisien yang kecil sehingga akan bergeser ke kanan dan produk SO3 bertambah.
• Bila suhu dinaikkan maka akan bergeser kearah endotermis, yaitu ke arah kiri.
Jawaban: B
(8). Volume Tekanan Mempengaruhi Pergeseran Kesetimbangan
Dalam ruang tertutup terdapat reaksi kesetimbangan:
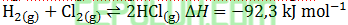
Ke mana arah keseimbangan akan bergeser jika suhu dinaikkan? A. ke kiri, harga tetapan kesetimbangan bertambah B. ke kiri, harga tetapan kesetimbangan berkurang C. ke kiri, harga tetapan kesetimbangan tetap D. ke kanan, harga tetapan kesetimbangan bertambah E. ke kanan, harga tetapan kesetimbangan tetap Jawab: B Pembahasan: Jika suhu dinaikkan, kesetimbangan akan bergeser ke arah reaksi endoterm. Jika suhu diturunkan, kesetimbangan akan bergeser ke arah reaksi eksoterm. Reaksi di atas eksoterm karena perubahan entalpi negatif. Sehingga suhu dinaikkan, kesetimbangan akan bergeser ke reaksi endoterm yaitu ke kiri reaktan.
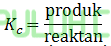
Nilai reaktan membesar maka tetapan kesetimbangan berkurang.
(9). Faktor yang Memengaruhi Pergeseran Kesetimbangan
26. Diketahui reaksi kesetimbangan:
2NO2(g) ⇌ N2(g) ΔH= + 65,68 kJ moI-1 dengan nilai tetapan kesetimbangan K = 125. Apabila suhu dinaikkan, nilai tetapan kesetimbangan menjadi lebih kecil dari 125.
SEBAB
Reaksi 2NO2(g) ⇌ N2(g) + 2O2(g) bersifat eksotermik.
26. Pembahasan:
Salah satu faktor yang memengaruhi pergeseran kesetimbangan adalah suhu. Jika suhu dinaikkan maka kesetimbangan bergeser kearah endoterm.
Ingat!
| Nilai K hanya dipengaruhi suhu: • Endoterm : suhu naik, K meningkat • Eksoterm : suhu naik, K menurun untuk reaksi kesetimbangan : |
2NO2(g) ⇄ N2(g) + 2O2(g) ΔH = + 65,68 kJ/mol K=125
Reaksi bersifat endoterm maka kenaikan suhu menyebabkan kesetimbangan bergeser ke kanan dan nilai K meningkat (K > 125).
Jawaban: E
(10). Volume Tekanan Mempengaruhi Pergeseran Kesetimbangan
Reaksi pembuatan belerang trioksida adalah eksoterm dapat meningkat dengan cara:
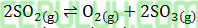
Produksi belerang trioksida dapat meningkat dengan cara ….(1). Menaikan tekanan (2). Menambah katalis (3). Menurunkan suhu (4). Memperbesar volume Cara yang tepat ….
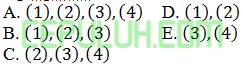
Jawab: E Bahas: Supaya pergeseran kesetimbangan ke arah belerang trioksida (produk. kanan) maka (3). Menurunkan suhu supaya pergeseran kesetimbangan ke arah reaksi eksoterm (ke arah belerang trioksida). (4). Menurunkan tekanan (memperbesar volume) supaya pergeseran kesetimbangan ke arah ruas yang jumlah koefisiennya lebih besar (di reaksi ini reaktan dua. produk tiga). Menambah katalis hanya mempercepat terjadi kesetimbangan tidak menggeser kesetimbangan.
Kesetimbangan Kimia: Tetapan Kesetimbangan KC KP
Kesetimbangan Kimia # Pergeseran Kesetimbangan