(1). Soal PG Pembahasan 2 Asam Basa Bronsted Lowry
Perhatikan reaksi asam basa berikut ini!
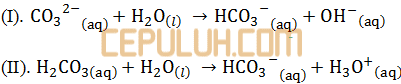
Pernyataan yang benar berdasarkan kedua reaksi di atas adalah ….
A. spesi HCO3–berlaku sebagai asam pada reaksi I dan basa pada reaksi II
B. spesi HCO3–berlaku sebagai basa pada reaksi I dan basa pada reaksi II
C. spesi HCO3–berlaku sebagai asam pada reaksi I juga pada reaksi II
D. spesi HCO3–berlaku sebagai basa pada reaksi I juga pada reaksi II
E. spesi HCO3–adalah asam yang lebih kuat daripada H2CO3
Jawab: A Pembahasan:
Jika biloks turun maka berubahnya asam menjadi basa konjugasi.
Jika biloks naik maka berubahnya basa menjadi asam konjugasi.
(I). Biloks CO32- menjadi HCO3– adalah naik dari -2 menjadi -1.
CO32- basa dan HCO3– asam konjugasinya.
(II). Biloks H2CO3 menjadi HCO3– adalah turun dari 0 menjadi -1.
H2CO3asam dan HCO3– basa konjugasinya.
Kesimpulannya HCO3– berlaku sebagai asam pada reaksi I dan basa pada reaksi II.
(2). Sifat Amfoter @ Asam-Basa Konjugasi
4. Berdasarkan reaksi-reaksi di bawah ini:
A. H2CO3 + H2O ⇔ H3O+ + HCO3–
B. HCO3– + H2O ⇔ H3O+ + CO32-
C. HCO3– + H2O ⇔ H2CO3 + OH–
dapat dikatakan bahwa …
(1) Asam H2CO3 mempunyai keasaman lebih besar daripada asam HCO3–.
(2) HCO3‘– bersifat amfoter.
(3) Ion CO32- merupakan basa konjugasi dari HCO3–.
(4) pada reaksi C di atas, H2O bersifat sebagai asam konjugasi dari OH–.
4. Pembahasan:
(1) H2CO3 memiliki ion H+ lebih banyak sehingga bersifat lebih asam.
(2) HCO3– bersifat amfoter dapat menerima dan memberi H+.
(3) Ion CO32- merupakan basa konjugasi dari HCO3– karena HCO3– mendonorkan H+ dan membentuk CO32-.
(4) OH– jika menerima H+ maka membentuk H2O yang merupakan asam konjugasi.
Jawaban: E
(3). Reaksi Asam-Basa menurut Bronsted-Lowry
3. Perhatikan reaksi asam-basa menurut Bronsted-Lowry berikut!
(1) NH4+(aq) + H2O(ℓ) ⮂ NH3(aq) + H3O+(aq)
(2) CH3COOH(aq) + HNO2(aq) ⮂ CH3COOH2+(aq) + NO2–(aq)
Spesi yang merupakan pasangan asam-basa konjugasinya adalah …
A. CH3COOH dengan NH3
B. NH4+ dengan NH3
C. NH3 dengan H3O+
D. CH3COOH dengan NO2–
E. NH4+ dengan H2O
3. Pembahasan:
Pasangan asam-basa konjugasi memiliki ciri-ciri:
• Senyawanya memiliki strukturyang mirip
• Mempunyai perbedaan selisih 1 atom H
Contoh: NH4+ dengan NH3, CH3COOH2+ dengan CH3COOH.
Jawaban: B
(4). Soal PG Pembahasan 4 Asam Basa Bronsted Lowry
Perhatikan reaksi berikut ini!

Pernyataan yang benar adalah ….
A. reaksi (i) H2O bersifat asam.
B. reaksi (ii) H2O bersifat basa.
C. reaksi (i) dan (ii) H2O bersifat basa.
D. reaksi (ii) H2O bersifat asam.
E. reaksi (i) dan (ii) H2O bersifat asam.
Jawab: D Pembahasan:
Jika biloks turun maka berubahnya asam menjadi basa konjugasi.
Jika biloks naik maka berubahnya basa menjadi asam konjugasi.
(i). Biloks H2O menjadi H3O+ adalah naik dari 0 menjadi +1.
Maka H2O adalah basa.
(ii). Biloks H2O menjadi OH– adalah turun dari 0 menjadi -1.
Maka H2O adalah asam.
(5). Soal PG Pembahasan 6 Asam Basa Bronsted Lowry
Asam sulfat H2SO4 dalam air mengalami dua tahap reaksi sebagai berikut:
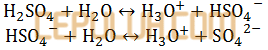
pada reaksi di atas yang merupakan pasangan asam basa konjugasi menurut Bronsted Lowry adalah ….
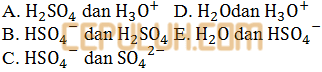
Jawab: C pembahasan:
Cara cepat memahami asam-basa Bronsted Lowry:
Asam mengalami penurunan biloks menjadi basa konjugasinya dari kiri ke kanan.
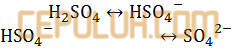
(6). Amonia Asam Basa Bronsted-Lowry Donor Akseptor
7. pada reaksi manakah amonia bersifat sebagai basa?
(1) Reaksi dengan air menghasilkan NH4+(aq) dan OH–(aq)
(2) Reaksi dengan ion Cu2+(aq) menghasilkan Cu(NH3)42+(aq)
(3) Reaksi dengan hidrogen klorida menghasilkan NH4+ + Cl–(s)
(4) Reaksi dengan oksigen menghasilkan NO (g) dan H2O (g)
7. Pembahasan:
Teori asam basa Bronsted-Lowry:
asam: donor (pemberi) H+
basa: akseptor (penerima) H+
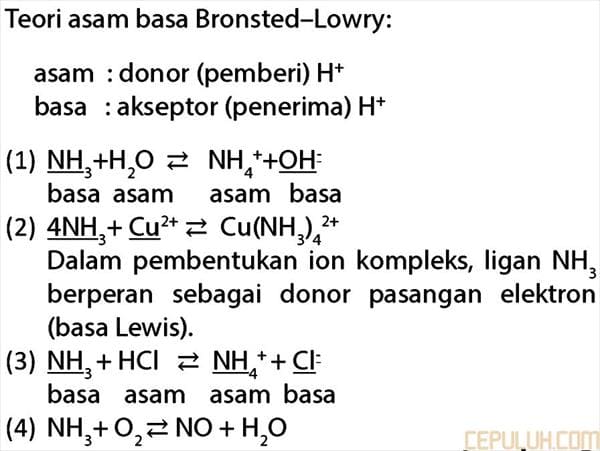
Jawaban: B
(7). Konsep Asam-Basa Arrhenius, Bronsted-Lowry dan Lewis
Perhatikan persamaan reaksi berikut!
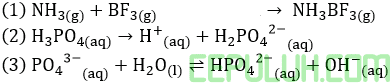
Urutan yang sesuai dengan konsep asam-basa Arrhenius, Bronsted-Lowry dan Lewis adalah ….
Jawab: C Bahas:
(2). Arrhenius, Asam adalah suatu zat yang bila dilarutkan di dalam air akan menghasilkan ion H+.
(3). Bronsted-Lowry, H2O sebagai asam karena melepas atau mendonor H+. Jadi PO43- sebagai basa.
(1). Lewis, NH3 sebagai basa karena pasangan elektron bebas atom N menancap ke atom B asam BF3.
(8). Soal PG Pembahasan 5 Asam Basa Bronsted Lowry
Perhatikan persamaan reaksi kimia:
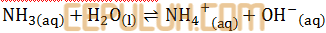
yang merupakan basa Bronsted-Lowry adalah ….

Jawab: B pembahasan:
Asam, jika biloks turun. Basa, jika biloks naik.
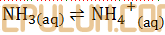
NH3(aq) adalah basa.
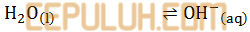
OH–(aq) adalah basa.
(9). Pasangan Asam Dan Basa Konjugasi
20. Pasangan asam dan basa konjugasi pada reaksi di bawah ini:
H2PO4– + H2O ⇔ HPO42- + H3O+
adalah …
1. H2PO4– dan HPO42-
2. H2PO4– dan H3O+
3. H2O dan H3O+
4. HPO42- dan H3O+
20. Pembahasan:
Pasangan asam dan basa hanya selisih satu ion H+,
yaitu H2PO4– dan HPO42-; H2O dan H3O+.
Jawaban: B
(10). Asam-Basa Bronsted-Lowry
12. Di antara reaksi-reaksi berikut yang menunjukkan CH3COOH bersifat basa adalah …
1. CH3COOH + HF ⇔ CH3COOH2+ + F–
2. CH3COOH + H2S ⇔ CH3COOH2+ + HS–
3. CH3COOH + H2CO3 ⇔ CH3COOH2+ + HCO3–
4. CH3COOH + H2O ⇔ CH3COO– + H3O+
12. Pembahasan:
CH3COOH akan membentuk CH3COOH2+ jika menerima H+ (bersifat basa).
Jawaban: A