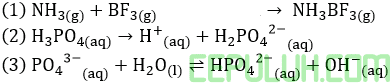(1). Asam Basa Kuat Lemah Arrhenius
Diantara kelompok asam berikut ini yang bervalesi dua adalah ….
A. asam nitrat, asam cuka, asam fosfat
B. asam sulfit, asam karbonat, asam asetat
C. asam nitrat, asam klorida, asam sulfat
D. asam sulfat, asam sulfida, asam karbonat
E. asam sulfat, asam sulfida, asam nitrat
Jawab: D Pembahasan:
Asam cuka CH3COOH→CH3COO–+H+
Asam karbonat H2CO3→2H++CO32- (2 valensi,divalen)
Asam klorida HCl→H++Cl– (1 valensi,monovalen)
Asam nitrat HNO3→H++NO3– (1 valensi,monovalen)
Asam fosfat H3PO4→3H++PO43- (3 valensi,trivalen)
Asam sulfat H2SO4→2H++SO42- (2 valensi,divalen)
Asam Sulfida H2S→2H++S2- (2 valensi,divalen)
Asam sulfit HSO3→H++SO3– (1 valensi,monovalen)
(2). Asam Basa Kuat Lemah Arrhenius
Contoh senyawa basa kuat dan asam kuat berurutan adalah ….

Jawab: D Pembahasan:
Senyawa basa di air melepaskan ion OH–.
Basa kuat di antaranya hidroksi alkali (IA) dan alkali tanah (IIA) biloks (+ dan 2+):

Basa lemah di antaranya amonium hidroksida NH4OH.
Senyawa asam di air melepaskan ion H+.
Asam kuat di antaranya asam halogen (VIIA), kecuali asam florida HF:
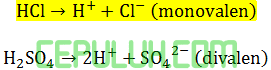
Basa lemah di antaranya asam asetat CH3COOH dan sianida HCN.
(3). Arrhenius @ Hidrolisis
19. Dalam larutan (NH4)2SO4 terjadi reaksi
NH4+ + H2O ⇔ NH3 + H3O+
Reaksi ini …
1. menurut teori Arrhenius adalah reaksi hidrolisis
2. Mengakibatkan pH larutan lebih rendah daripada pH air
3. menurut teori Bronsted-Lowry merupakan reaksi prolitik
4. Menunjukkan bahwa ion NH4+ berperan sebagai asam
19. Pembahasan:
NH4+ + H2O ⇔ NH3 + H3O+
1. Reaksi dengan air = reaksi hidrolisis
2. H3O+ menurunkan pH air
3. Reaksi prolitik = reaksi perpindahan H+
4. NH4+ asam sebab memberikan H+
Jawaban: E
(4). Asam Basa Kuat Lemah Arrhenius
Asam kuat memiliki sifat berikut ini, kecuali ….
A. mempunyai nilai tetapan kesetimbangan (Ka) yang besar.
B. merupakan konduktor yang baik
C. mempunyai pH rendah
D. mempunyai lebih dari satu atom H dalam molekulnya
E. mempunyai derajat ionisasi hampir nol.
Jawab: E Pembahasan:
Sifat asam kuat:
∎ tetapan kesetimbangan asam (Ka) besar
∎ konduktor yang baik, larutan elektrolit.
∎ kekuatan asam pH rendah, pH < 3 rentang 0 < pH < 14.
∎ monovalen, satu atom H misal HCl, tapi ada yang lebih dari satu yaitu divalen misal H2SO4,
∎ mempunyai derajat ionisasi α=1 karena habis bereaksi.
(5). Larutan yang Bersifat Lebih Basa
15. pada konsentrasi, suhu, dan tekanan yang sama, larutan NaOH bersifat lebih basa daripada larutan Ca(OH)2.
SEBAB
Unsur Na memiliki nilai keelektronegatifan yang lebih tinggi daripada unsur Ca.
15. Pembahasan:
pada konsentrasi, suhu dan tekanan yang sama, sifat basa larutan NaOH lebih rendah daripada larutan Ca(OH)2. Hal ini disebabkan karena pada larutan Ca(OH)2, konsentrasi OH– berjumlah dua kali lipat. Unsur Na memiliki keelekronegatifan lebih tinggi daripada Ca.
Jawaban: D
(6). Asam Basa Kuat Lemah Arrhenius
Diantara kelompok asam berikut ini yang tergolong asam kuat adalah ….
A. asam klorida, asam sufat, asam asetat
B. asam sulfat, asam nitrat, asam klorida
C. asam karbonat, asam asetat, asam fosfat
D. asam sulfida, asam fluorida, asam sianida
E. asam asetat, asam klorida, asam fosfat
Jawab: B Pembahasan:
Contoh asam lemah: asam asetat CH3COOH, asam karbonat H2CO3, asam fosfat H3PO4, asam Sulfida H2S, asam fluorida HF asam sianida HCN.
Contoh asam kuat: asam klorida HCl, asam sulfat H2SO4, asam nitrat HNO3.
(7). Asam Basa Kuat Lemah Arrhenius
Larutan senyawa berikut yang merupakan basa kuat adalah ….
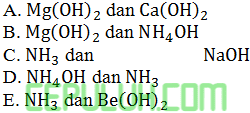
Jawab: A Pembahasan:
Senyawa basa di air melepaskan ion OH–.
Basa kuat di antaranya hidroksi alkali (IA) dan alkali tanah (IIA) biloks (+ dan 2+):
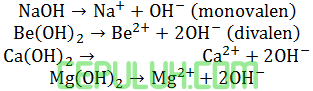
Basa lemah di antaranya amonium hidroksida NH4OH dan amonia NH3 jika direaksikan dengan air.
(8). Asam Basa Kuat Lemah Arrhenius
Tergolong larutan asam lemah dan basa kuat adalah ….
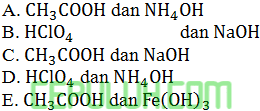
Jawab: C Pembahasan:
Contoh asam lemah: asam asetat CH3COOH.
Contoh asam kuat: asam perklorat HClO4.
Contoh basa lemah: amonium hidroksida NH4OH, besi (III) hidroksida Fe(OH)3.
Contoh basa kuat: natrium hidroksida NaOH.
(9). Senyawa yang Bereaksi dengan Air Membentuk Basa
8. Senyawa-senyawa berikut ini dapat bereaksi dengan air membentuk basa adalah …
(1) Li2O (2) CO2 (3) CaO (4) SO2
8. Pembahasan:
Oksida basa (O + logam) bereaksi dengan air membentuk basa, sedangkan oksida asam (O + nonlogam) bereaksi dengan air membentuk asam.
Jawaban: B
(10). Asam Basa Kuat Lemah Arrhenius
Soal Pembahasan 1 Asam Basa Kuat Lemah Arrhenius
Suatu indikator memberikan warna merah dengan larutan kapur sirih. Indikator ini akan berwarna merah juga dalam larutan ….
A. air jeruk
B. air sabun
C. larutan cuka
D. larutan gula
E. larutan garam dapur
Jawab: B Pembahasan:
Air sabun karena bersifat basa seperti kapur sirih.
Larutan Asam-Basa # pH pOH Sisa Kuat
Larutan Asam-Basa # Warna Indikator Trayek pH
Larutan Asam-Basa # Titrasi Asam Basa
Larutan Asam-Basa # Bronsted Lowry Konjugasi Donor Akseptor
Larutan Asam-Basa # Arrhenius