(1). Persamaan Laju Reaksi
15. dari reaksi 2NO(g) + 2H2(g) ➔ N2(g) + 2H2O(g)
diperoleh data percobaan seperti di bawah.
| Percobaan | [NO](M) | [H2](M) | Laju reaksi (M/detik) |
|---|---|---|---|
| 1 | 2·10-3 | 2·10-3 | 4·10-6 |
| 2 | 4·10-3 | 2·10-3 | 8·10-6 |
| 3 | 6·10-3 | 2·10-3 | 12·10-6 |
| 4 | 4·10-3 | 6·10-3 | 24·10-6 |
| 5 | 4·10-3 | 8·10-3 | 32·10-6 |
Persamaan laju reaksi untuk reaksi tersebut adalah …
A. v = k.[NO][H2]
B. v = k.[NO]2[H2]
C. v = k.[NO][H2]2
D. v = k.[NO]2[H2]2
E. v = k.[H2]2
15. Pembahasan:
Ingat!
untuk mencari orde terhadap H2 digunakan perbandingan laju reaksi dengan konsentrasi H2 tetap (data percobaan 1 dan 2).
untuk mencari orde terhadap H2 digunakan perbandingan laju reaksi dengan konsentrasi NO tetap (data percobaan 4 dan 5).
Persamaan laju reaksi adalah v = k [NO][H2].

Jawaban: A
(2). Persamaan Laju Reaksi Diketahui Waktu Reaksi
Data hubungan konsentrasi dan lama waktu reaksi diperoleh dari persamaan:
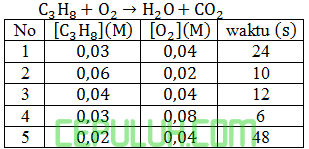
Persamaan laju reaksinya adalah ….
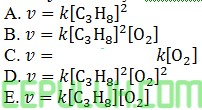
Jawab: D Pembahasan:
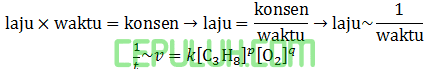
waktu (t) berbanding terbalik dari laju.
untuk mencari orde [C3H8], pilih konsentrasi [O2] sama. Pilih reaksi 3 dan 5.
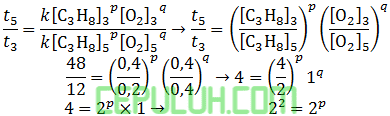
Orde reaksi C3H8 adalah p=2.
untuk mencari orde [O2], pilih konsentrasi [C3H8] sama. Pilih reaksi 4 dan 1.
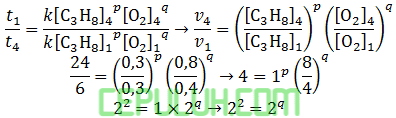
Orde reaksi [O2] adalah q=2.
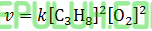
(3). Persamaan Laju Reaksi
13. Zat A dapat bereaksi dengan zat B menjadi zat C, menurut persamaan reaksi: A + 2B ➔ C
| Percobaan | Konsentrasi Awal (M) | Waktu Reaksi (detik) | |
|---|---|---|---|
| A | B | ||
| 1 | 0,01 | 0,1 | 864 |
| 2 | 0,02 | 0,4 | 54 |
| 3 | 0,03 | 0,3 | 32 |
| 4 | 0,04 | 0,2 | 27 |
Berdasarkan data percobaan di atas, persamaan laju reaksinya adalah …
A. v = k[A][B]½
B. v = k[A][B]
C. v = k[A][B]2
D. v = k[A]2[B]
E. v = k[A]2[B]2
13. Pembahasan:
Persamaan laju reaksi dapat ditentukan berdasarkan data percobaan. untuk reaksi A + 2B ➔ C maka persamaan lajunya:
v = k [ A]x[B]y
x = orde terhadap A
y = orde terhadap B
dari data 1 dan 2:
Substitusi persamaan (2) ke (1):

Jawaban: D
(4). Rumus Persamaan Laju Reaksi
untuk reaksi
diperoleh data sebagai berikut. Jika konsentrasi A dinaikkan tiga kali pada konsentrasi B tetap, laju reaksi menjadi sembilan kali lebih cepat. Jika konsentrasi A dan B dinaikkan tiga kali, laju reaksi menjadi 27 kali lebih cepat. Persamaan laju reaksinya adalah ….
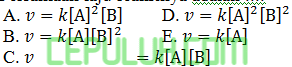
Jawab: A Pembahasan:
Misal [A]=1, [B]=1 dan v=1
Misal [A]=1×3, [B]=1 tetap maka v=1×9
Misal [A]=1×3, [B]=1×3 maka v=1×27
Perbandingan (ii) dan (i):
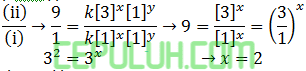
Perbandingan (iii) dan (i):
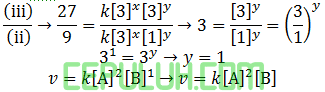
(5). Rumus Persamaan Laju Reaksi
konsentrasi X tetap dan Y diperbesar 2 kali semula, laju reaksinya menjadi 4 kali lebih cepat.Jika konsentrasi Y tetap dan konsentrasi X diperbesar 3 kali semula laju reaksinya menjadi 9 kali lebih cepat, maka persamaannya ….
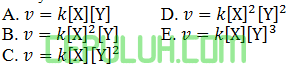
Jawab: D Pembahasan:
Misal [X]=1, [Y]=1 dan v=1
Misal [X]=1 tetap, [Y]=1×2 maka v=1×4
Misal [X]=1×3, [Y]=1 tetap maka v=1×9
Perbandingan (ii) dan (i):
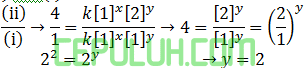
Perbandingan (iii) dan (i):
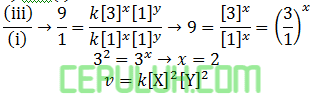
(6). Rumus Persamaan Laju Reaksi
Data pada suhu 273℃ untuk laju reaksi:
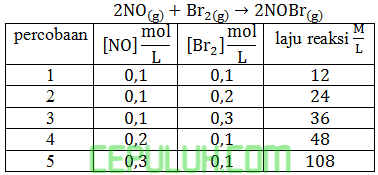
Persamaan laju reaksi adalah …
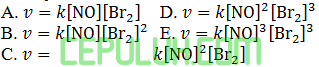
Jawab: C Pembahasan:
untuk mencari orde [NO], pilih konsentrasi [Br2] sama. Pilih reaksi 4 dan 1.
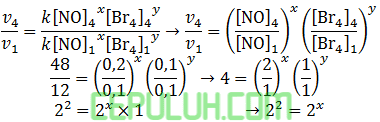
Tingkat reaksi, Orde [NO] sama dengan x=2.
untuk mencari orde [Br2], pilih konsentrasi [NO] sama. Pilih reaksi 2 dan 1.
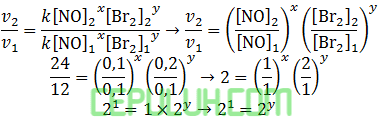
Tingkat reaksi, orde [Br2] sama dengan y=1
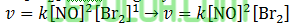
(7). Rumus Persamaan Laju Reaksi
Perhatikan data tabel percobaan laju reaksi!
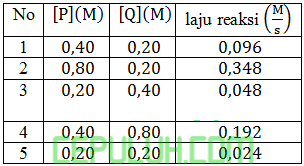
Persamaan laju reaksinya adalah ….

Jawab: E Pembahasan:
untuk mencari orde [P], pilih konsentrasi [Q] sama. Pilih reaksi 1 dan 5.
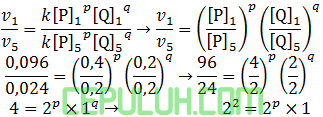
Orde [P] p=2.
untuk mencari orde [Q], pilih konsentrasi [P] sama. Pilih reaksi 3 dan 5.
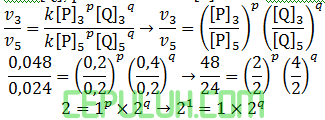
Orde [Q] q=1.
(8). Laju Reaksi Jika Konsentrasi NO dan Br
14. Data hasil eksperimen dari reaksi:
2NO(g) + Br2(g) ➔ 2NOBr(g)
diperoleh data sebagai berikut:
| No. | [NO]M | [Br2]M | Laju reaksi M/det |
|---|---|---|---|
| 1. | 0,1 | 0,1 | 0,12 |
| 2. | 0,1 | 0,2 | 0,24 |
| 3. | 0,2 | 0,1 | 0,48 |
Laju reaksi yang terjadi jika konsentrasi NO dan Br2 masing-masing 0,3 M dan 0,1 M adalah …
A. v = k[0,3] [0,1] D. v = k[0,3]2
B. v = k[0,3] [0,1]2 E. v=k[0,1]
C. v = k[0,3]2[0,1]
14. Pembahasan:
Ingat!

Jawaban: C
(9). Rumus Persamaan Laju Reaksi
Suatu reaksi
mempunyai data sebagai berikut
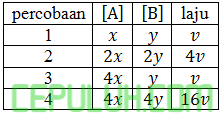
Persamaan kecepatan lajunya adalah .…
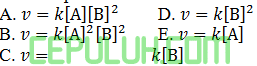
Jawab: D Pembahasan:
untuk mencari orde [A], pilih konsentrasi [B] sama. Pilih reaksi 3 dan 1.
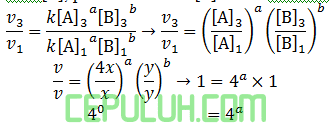
Orde [A] a=0.
untuk mencari orde [B], pilih konsentrasi [A] sama. Pilih reaksi 4 dan 3.
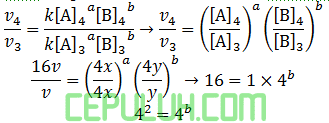
orde [B] b=2
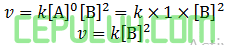
(10). Rumus Persamaan Laju Reaksi
Soal Pembahasan 1 Rumus Persamaan Laju Reaksi
dari data suatu reaksi kimia
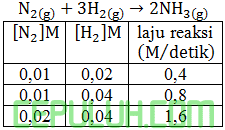
rumus laju reaksi adalah ….
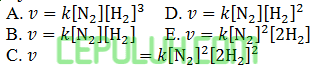
Jawab: B Pembahasan:
untuk mencari orde [N2], pilih konsentrasi [H2] sama. Pilih reaksi bawah (3) dan tengah (2).
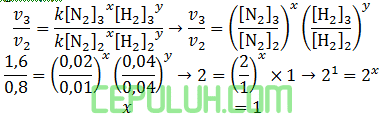
untuk mencari orde [H2], pilih konsentrasi [N2] sama. Pilih reaksi atas (1) dan tengah (2).
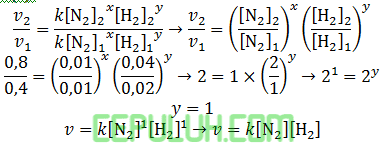
Laju Reaksi # Laju Kecepatan
Kesetimbangan Kimia # Pergeseran Kesetimbangan
Elektrokimia # Elektrolisis Faraday Endapan Arus Listrik
Rumus Persamaan Laju Reaksi









