(1). Faktor yang Memengaruhi Laju Reaksi
5. Dalam wadah tertutup, penguraian sulfuril klorida (SO2Cl2) menurut reaksi:
SO2Cl2(g) ➔ SO2(g) + Cl2(g)
mempunyai laju r = K[SO2Cl2]. Pernyataan yang benar untuk reaksi tersebut adalah …
A. laju reaksi (r) akan semakin cepat selama reaksi berlangsung
B. laju reaksi (r) menjadi lebih cepat jika volume wadah diperbesar
C. konsentrasi SO2 akan bertambah dengan laju sebesar r
D. konsentrasi SO2Cl2 akan bertambah dengan laju sebesar r
E. satuan konstanta laju reaksi (k) adalah M-1·s-1
5. Pembahasan:
■ Satuan laju reaksi mol L-1·s-1
■ Konstanta laju reaksi mol-2·dm6·s-1
■ Faktor yang memengaruhi laju reaksi:
■✓ Konsentrasi pereaksi
■✓ Tekanan
■✓ Luas permukaan bidang sentuh
■✓ Suhu/temperatur
Jika volume wadah diperbesar maka luas permukaan bidang sentuh menjadi makin besar sehingga laju reaksi lebih cepat.
Jawaban: B
(2). Laju Reaksi Turun Menjadi Setengahnya
18. untuk reaksi:
(CH3)3CBr(aq) + OH–(aq) ➔ (CH3)3COH(aq) + Br–(aq)
diketahui bahwa apabila konsentrasi (CH3)3CBr diturunkan menjadi setengahnya, laju reaksi turun menjadi setengahnya. Tetapi apabila konsentrasi OH– diturunkan menjadi setengahnya, tidak ada pengaruh terhadap laju reaksi.
Persamaan laju reaksi secara keseluruhan untuk reaksi di atasadalah …
A. laju = k[(CH3)3CBr]½[OH–]
B. laju = k[(CH3)3CBr]2[OH–]
C. laju = k[(CH3)3CBr]½
D. laju = k[OH–]
E. laju = k[(CH3)3CBr]
18. Pembahasan:
Persamaan laju reaksi:
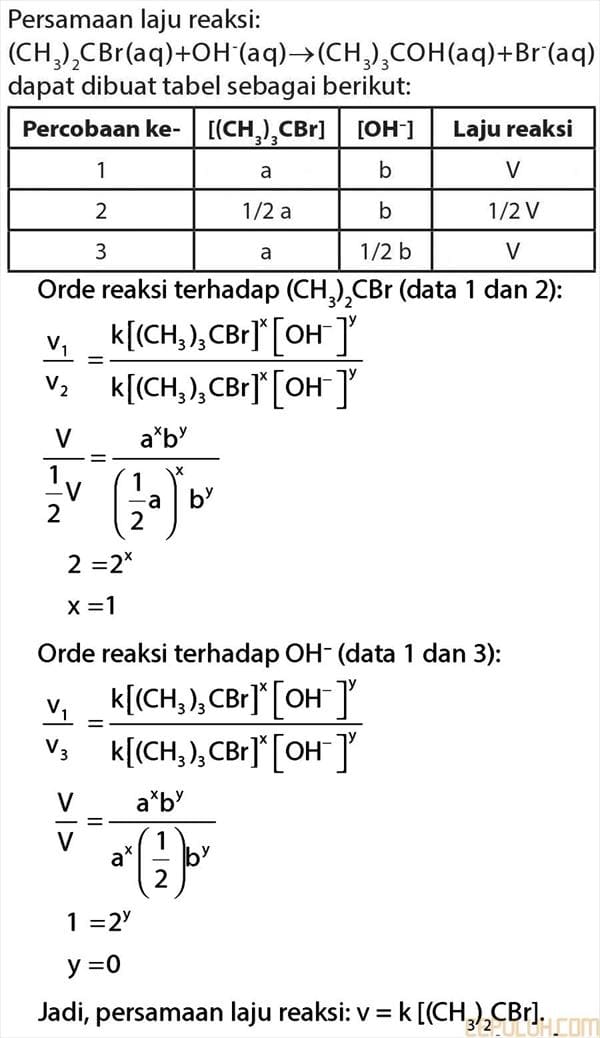
Jadi, persamaan laju reaksi: v = k [(CH 3)2CBr].
Jawaban: E
(3). Faktor yang Memengaruhi Laju Reaksi
25. Laju reaksi lebih cepat untuk reaktan cair daripada reaktan gas.
SEBAB
Semakin bebas partikel reaktan bergerak maka laju reaksinya semakin besar.
25. Pembahasan:
Salah satu faktor yang memengaruhi laju reaksi adalah luas permukaan bidang sentuh.
Semakin luas permukaan maka semakin banyak tempat bersentuhan untuk berlangsungnya reaksi. Luas permukaan zat dapat dicapai dengan cara memperkecil ukuran zat tersebut.
Laju reaksi senyawa dengan wujud zat gas lebih cepat dibanding cair, dan wujud cair lebih cepat dibanding padat. (Pernyataan salah)
Luas permukaan makin besar menyebabkan jumlah tumbukan makin besar sehingga diharapkan laju reaksi makin besar. (Alasan benar)
Jawaban: D
(4). Laju Reaksi Hanya Dipengaruhi Oleh Luas Permukaan
27. Ke dalam 5 wadah yang berbeda, masing dimasukkan 4 gram garam yang dilarutkan dalam air. Gambar percobaan pelarutan garam tersebut sebagai berikut:
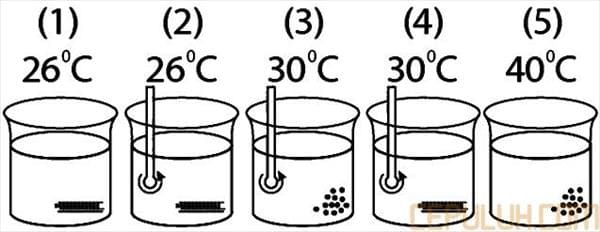
Laju reaksi yang hanya dipengaruhi oleh luas permukaan ditunjukkan pada gambar …
A. 1 dan 2 D. 3 dan 5
B. 2 dan 3 E. 4 dan 5
C. 3 dan 4
27. Pembahasan:
Gambar 3 dan 4 menunjukkan bahwa laju reaksi hanya dipengaruhi oleh luas permukaan karena pada gambar tersebut suhu larutan sama dan pengaruh pengadukan juga sama.
Jawaban: C
(5). Helium Memiliki Laju Efusi yang Sama dengan Gas Nitrogen
24. pada suhu yang sama, gas helium memiliki laju efusi yang sama dengan gas nitrogen.
SEBAB
Laju efusi ditentukan oleh suhu.
24. Pembahasan:
Laju efusi suatu gas berbanding terbalik dengan akar massa molar gas. Laju efusi gas He dan N2 berbanding sebagai:

Laju efusi gas helium lebih tinggi dari gas nitrogen.
Laju efusi juga dipengaruhi oleh suhu.
Jawaban: D
(6). Memperbesar Laju Reaksi
9. Di antara pernyataan berikut, yang tidak benar adalah …
A. katalisator memperbesar laju reaksi
B. makin besar energi aktivasi makin cepat reaksi berlangsung
C. laju reaksi ditentukan oleh tahap reaksi yang berlangsung paling lambat
D. katalisator tidak mengubah entalpi reaksi
E. makin besar konsentrasi pereaksi makin besar frekuensi tumbukan
9. Pembahasan:
Energi aktivasi adalah energi minimal yang harus dimilikiagarsuatu reaksi dapat berlangsung. Energi aktivasi semakin tinggi maka reaksi berlangsung semakin lambat.
Jawaban: B
(7). Mempercepat Reaksi
24. pada reaksi:
2A(s) + 3B2(g) ➔ 2AB3(g) ΔH = 120 kJ
untuk mempercepat reaksi dengan cara:
1. Menggiling A
2. Memperbesar volume wadah
3. Meningkatkan tekanan
4. Menurunkan suhu
24. Pembahasan:
Cara mempercepat reaksi:
♦ Memperbesar luas permukaan dengan jalan menggiling A
♦ Meningkatkan tekanan sehingga reaksi bergeser ke jumlah koefisien yang lebih kecil, yaitu ke kanan.
Jawaban: B
(8). Katalis @ Laju Reaksi @ Kesetimbangan Reaksi
11. Katalis memengaruhi tetapan kesetimbangan reaksi
SEBAB
Katalis memengaruhi laju reaksi.
11. Pembahasan:
Katalis tidak memengaruhi besar tetapan keseimbangan reaksi. Namun, katalis memengaruhi laju reaksi yakni dengan penambahan katalis mengakibatkan laju reaksi semakin cepat.
Jawaban: D
(9). Harga Tetapan Laju Reaksi Kimia Dipengaruhi Oleh
10. Harga tetapan laju reaksi kimia dipengaruhi oleh …
1. Luas permukaan
2. Suhu
3. Katalis
4. Konsentrasi reaktan
10. Pembahasan:
Harga tetapan laju reaksi dipengaruhi oleh luas permukaan, suhu, katalis, dan konsentrasi reaktan.
Jawaban: E
Laju Reaksi # Bagan Gambar Grafik Diagram
Laju Reaksi # Faktor Kali Perubahan Suhu Volume
Laju Reaksi # Konstanta Tetapan
Laju Reaksi # Orde Total Tingkat
Laju Reaksi # Lama Waktu Reaksi
Rumus Persamaan Laju Reaksi
Laju Reaksi # Laju Kecepatan