(1). Laju Reaksi Kimia
Kalium iodide dioksidasi oleh natrium hipoklorit menjadi kalium hipoiodit dalam larutan basa menurut persamaan reaksi berikut.
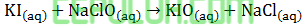
Berdasarkan percobaan dieroleh data sebagai berikut
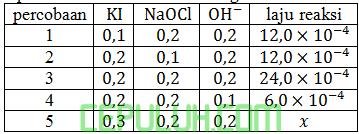
Nilai x adalah ….
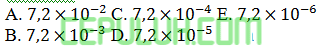
Jawab: B Pembahasan:
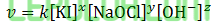
untuk mencari orde [KI], pilih [NaOCl] sama dan [OH–] sama. Pilih reaksi 3 dan 1.
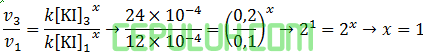
untuk mencari orde [NaOCl], pilih [KI] sama dan [OH–] sama. Pilih reaksi 3 dan 1.
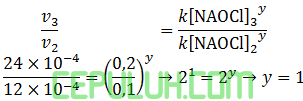
untuk mencari orde [OH–], pilih [KI] sama dan [NAOCl] sama. Pilih reaksi 3 dan 4.
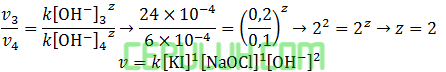
Masukan data yang mudah dihitung, pilih no 1:
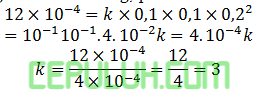
Masukan data percobaan 5:
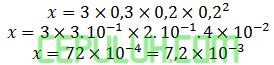
(2). Laju Reaksi Kimia
Persamaan reaksi:
diperoleh data sebagai berikut:
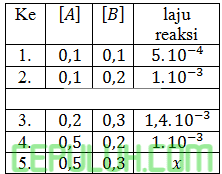
Pernyataan di bawah ini benar,kecuali ….
A. Laju reaksi terhadap A adalah 1
B. Laju reaksi terhadap B adalah 1
C. Tetapan lajunya adalah 5.10-3
D. Nilai x adalah1,5.10-3
E. Orde reaksi total adalah 1
Jawab: A Pembahasan:
untuk mencari orde [A], pilih konsentrasi [B] sama. Pilih reaksi 4 dan 2.
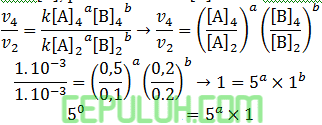
Laju reaksi terhadap [A] orde a=0.
untuk mencari orde [B], pilih konsentrasi [A] sama. Pilih reaksi 2 dan 1.
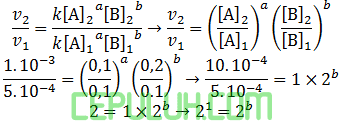
Laju reaksi terhadap [B] orde b=1
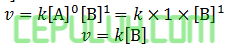
Orde reaksi total a+b=0+1=1.
Tetapan laju reaksi ini, karena [A] tidak berpengaruh masukan saja [B] percobaan 1:
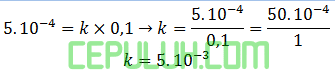
Laju percobaan 5:
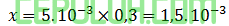
(3). Laju Reaksi Apabila Konsentrasi No dan Br2
9. Gas nitrogen oksida dan gas bromin bereaksi pada 0°C menurut persamaan:
2NO(g) + Br2(g) ➔ 2NOBr(g)
Laju reaksi diikuti dengan mengukur pertambahan konsentrasi NOBr dan diperoleh data sebagai berikut:
| Percobaan | [NO](M) | [Br2](M) | Laju awal pembentukan NOBr (M·s-1) |
|---|---|---|---|
| 1 | 0,1 | 0,1 | 12 |
| 2 | 0,1 | 0,2 | 24 |
| 3 | 0,2 | 0,1 | 48 |
| 4 | 0,3 | 0,1 | 108 |
Besarnya laju reaksi apabila konsentrasi NO dan Br2 masing-masing 0,2 M adalah … M·s-1
A. 48 B. 60 C. 72 D. 96 E. 108
9. Pembahasan:
Reaksi: xA + yB ➔ zC
Persamaan laju reaksi: v = k. [A]x·[B]y
Reaksi: 2 NO(g) + Br2(g) ➔ 2NOBr(g)
Persamaan laju reaksi: v = k. [NO]x·[Br2]y
Mencari orde NO (x) ➔ carilah data Br2 yang sama, yaitu data 3 dan 4.
Mencari orde Br2 (y) ➔ carilah data NO yang sama yaitu data 1 dan 2.
Persamaan laju reaksi: v = k. [NO]2·[Br2]1
Mencari harga k dari data 1.

Jawaban: D
(4). Laju Reaksi Logam Seng Asam Sulfat
4. Sekeping logam seng direaksikan dengan larutan asam sulfat 4 M dan bereaksi menurut reaksi:
Zn(s) + H2SO4(aq) ➔ ZnSO4(aq) + H2(g)
Data yang diperoleh setelah beberapa menit sebagai berikut:
| No | Suhu (°C) | Waktu (detik) | Volume H2 (cm3) |
|---|---|---|---|
| 1. | 27 | 0 | 0 |
| 2. | 27 | 20 | 5 |
| 3. | 27 | 40 | 10 |
Laju reaksi logam seng tersebut sebesar … cm3·det-1
A. 0,05 B. 0,10 C. 0,15 D. 0,20 E. 0,25
4. Pembahasan:
Terdapat reaksi:
Zn(s) + H2SO4(aq) ➔ ZnSO4(aq) + H2(g)
Berdasarkan reaksi tersebut, laju reaksi hanya dipengaruhi oleh konsentrasi H2 yang berfase gas. Oleh karena itu, laju reaksi pembentukan gas seng pada suhu 27°C dapat dihitung dengan menggunakan data percobaan (1) dan (2) atau percobaan (2) dan (3) sebagai berikut:

Jadi, laju reaksi logam seng tersebut sebesar 0,25 cm3·det-1
Jawaban: E
(5). Data Laju Reaksi Jika Konsentrasi
6. pada reaksi: A(g) + B(g) ➔ C(g) + D(g)
Diperoleh data laju reaksi sebagai berikut:
| Percobaan | [A]M | [B]M | v(M·s-1) |
|---|---|---|---|
| 1 | 0,1 | 0,6 | 12·10-3 |
| 2 | 0,2 | 0,6 | 48·10-3 |
| 3 | 0,2 | 1,2 | 48·10-3 |
Laju reaksi yang terjadi jika konsentrasi A = 0,3 M dan B = 0,4 adalah … ·10-1M·s-1.
A. 0,08 B. 1,02 C. 1,08 D. 2,00 E. 2,08
6. Pembahasan:
Persamaan laju reaksi: v = k [A]a·[B]b
Penentuanorde reaksi terhadap A, membandingkan 2 data percobaan dimana [B] konstan (percobaan 1 dan 2).

Penentuan orde reaksi terhadap B, membandingkan 2 data percobaan dimana [A] konstan (percobaan 2 dan 3).
Penentuan nilai k—♦ pilih salah satu data percobaan (percobaan 1)..
Jawaban: C
(6). Data Percobaan Laju Reaksi
7. Berikut ini diberikan data percobaan laju reaksi:
Q(g) + 2T(g) ➔ T2Q(g) pada beberapa kondisi:
| No. | [Q] | [T] | v (M/det) |
|---|---|---|---|
| 1 | 0,1 | 0,1 | 1,25·10-2 |
| 2 | 0,2 | 0,1 | 5·10-2 |
| 3 | 0,1 | 0,2 | ·10-1 |
Jika [Q] dan T] masing-masing diubah menjadi 0,5 M maka harga laju (v) reaksi itu adalah … M/det.
A. 5,0 B. 7,5 C. 10,5 D. 12,5 E. 39,0
7. Pembahasan:
untuk menentukan orde reaksi Q, lihat data [T] yang sama.
untuk menentukan orde reaksi T, lihat data [Q] yang sama.
– Orde reaksi terhadap Q ditentukan oleh percobaan 1 dan 2.
– Orde reaksi terhadap T ditentukan oleh percobaan 1 dan 3.
untuk menentukan nilai k, pergunakan data percobaan, misalnya percobaan 1.
Persamaan laju reaksi apabila [Q] = [T] = 0,5 M adalah:

Jawaban: E
(7). Orde Reaksi Tetapan Laju Reaksi
15. Data percobaan suatu reaksi:
2A + B2 ➔ 2AB
adalah sebagai berikut:
| No. | [A](M) | [B2](M) | Laju reaksi |
|---|---|---|---|
| 1. | 0,50 | 0,50 | 1,5·10-4 |
| 2. | 0,50 | 1,00 | 3,0·10-4 |
| 3. | 1,00 | 1,00 | 3,0·10-4 |
Pernyataan yang benar adalah …
1. Orde reaksi terhadap A adalah satu
2. Orde reaksi total adalah satu
3. Harga tetapan laju reaksi k= 1,0·10-4s-1
4. Rumus laju reaksinya v = k [A]0[B2]
15. Pembahasan:
Orde reaksi A (persamaan 2 dan 3):
Orde reaksi B2 (persamaan 1 dan 2):
orde reaksi total = 1
persamaan laju reaksi: v = k [A]0[B2]

Jawaban: C
(8). Laju Reaksi Kimia
suatu reaksi X(g)+3Y(g)→XY3(g) diperoleh data percobaan sebagai berikut:
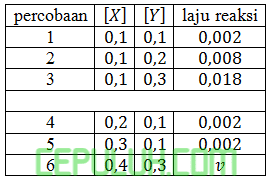
Nilai v adalah ….
A. 180 C. 1,8 E. 0,018
B. 18 D. 0,18
Jawab: E Pembahasan:
untuk mencari orde [X], pilih konsentrasi [Y] sama. Pilih reaksi 2 dan 1.
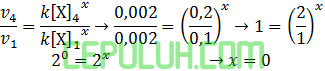
untuk mencari orde [Y], pilih konsentrasi [X] sama. Pilih reaksi 4 dan 1.
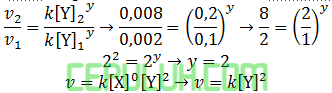
Pilih percobaan 1 mudah dihitung:
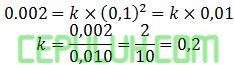
Persamaan laju reaksi ini:
Masukan data percobaan 6:
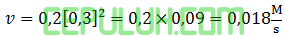
(9). Laju Pembentukan N2
12. Oksidasi NO menjadi NO2 menurut reaksi:
2NO(g) + O2(g) ➔ 2NO2(g)
memberikan data berikut:
| Percobaan | Konsentrasi NO(M) | Konsentrasi O2(M) | Laju Pembentukan N2(M/detik) |
|---|---|---|---|
| 1 | 0,001 | 0,001 | 7,10 |
| 2 | 0,004 | 0,001 | 28,40 |
| 3 | 0,004 | 0,003 | 255,6 |
| 4 | 0,002 | 0,002 | X |
Nilai X dalam tabel di atas (dalam M/detik) adalah …
A. 3,65 B. 14,20 C. 28,40 D. 56,80 E. 113,60
12. Pembahasan:
Orde reaksi terhadap O2 = x (konsentrasi NO tetap). Nomor 1 dan 2
Orde reaksi terhadap NO = y (konsentrasi O2tetap). Nomor 2 dan 3

Mencari nilai k (menggunakan percobaan 1).
Jawaban: D
(10). Konsentrasi Laju Reaksi
11. pada reaksi A + 2B ➔ AB2 diperoleh data sebagai berikut:
| Percobaan | [A]M | [B]M | Laju reaksi M/s |
|---|---|---|---|
| 1 | 0,1 | 0,2 | 4 |
| 2 | 0,1 | 0,4 | 8 |
| 3 | 0,2 | 0,2 | 16 |
Jika konsentrasi A = 0,3 dan B = 0,4 M maka laju reaksi adalah … M/s
A. 36 B. 48 C. 54 D. 72 E. 92
11. Pembahasan:
Rumus yang digunakan yaitu:
Orde reaksi terhadap A
pada [B] percobaan 1 dan 2 sama maka:
Qrde reaksi terhadap B
pada [B] percobaan 1 dan 2 sama maka:
Kemudian masukkan ke dalam persamaan:
dengan menggunakan percobaan nomor 1, dapat dihitung harga k:
Kemudian memasukkan ke dalam persamaan dengan konsentrasi A = 0,3 M dan konsentrasi B =

Jawaban: D
Kesetimbangan Kimia # Pergeseran Kesetimbangan
Elektrokimia # Elektrolisis Faraday Endapan Arus Listrik
Laju Reaksi # Laju Kecepatan