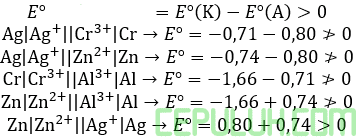(1). Elektrolisis Lelehan NaCl Elektroda Karbon Arus Ampere Selama Menit Massa Logam
39. Proses elektrolisis lelehan NaCl dengan elektroda karbon, digunakan arus sebesar 10 ampere selama 30 menit. Massa logam adalah …

39. Pembahasan:

Jawaban: A
(2). Sepuh Perak Dalam Larutan Perak Nitrat Kuat Arus Ampere Selama Menit
38. Sebuah patung disepuh dengan perak dalam larutan perak nitrat dengan kuat arus 50 ampere selama 20 menit. Banyaknya perak yang melapisi patung tersebut adalah …
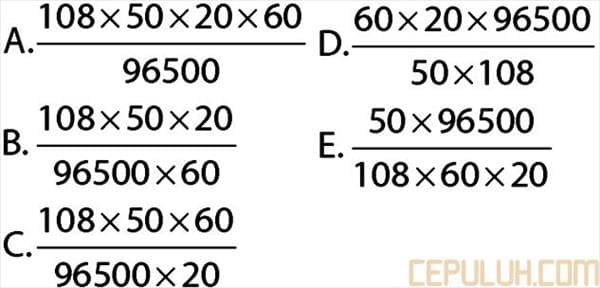
38. Pembahasan:
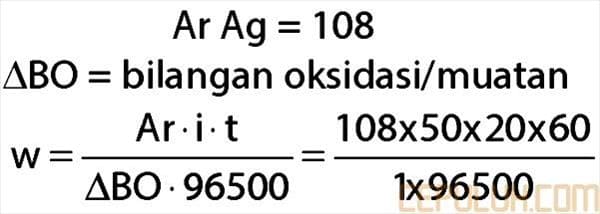
Jawaban: A
(3). Elektrolisis Larutan Perak Nitrat Elektroda Karbon
10. pada elektrolisis larutan perak nitrat dengan menggunakan elektroda karbon, persamaan reaksi yang terjadi pada anoda adalah …
A. Ag+(aq) + e ➔ Ag(s)
B. 2H2O(aq) + 2e ➔ 2OH–(aq) + H2O(g)
C. 2H2O(aq) ➔ 4H+(aq) + O2(g) + 4e
D. Ag(s) ➔ Ag+(aq) + e
E. 2NO3–(aq) ➔ 2NO2(g) + O2(g) + 2e
10. Pembahasan:
Elektrolisis larutan AgNO3:
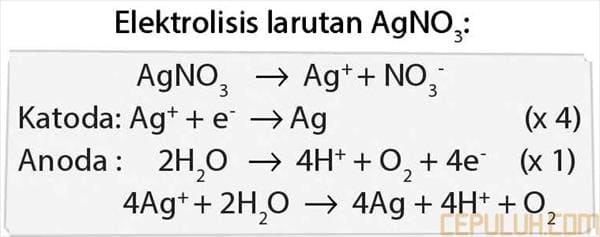
Jawaban: C
(4). Elektrolisis Waktu Mengendapkan Logam Krom Detik
37. Sebanyak 1 liter larutan CrCl3 1 M dielektrolisis dengan arus 6 ampere. Jika diketahui Ar Cr = 52; 1 F = 96.500 maka waktu yang diperlukan untuk mengendapkan logam krom sebanyak 3,88 gram tersebut adalah … detik.

37. Pembahasan:

Jawaban: C
(5). Kawat Dipotong Menjadi Bagian Sama Panjang Dihubungkan Paralel Ke Baterai Arus Mengalir
9. Sebuah kawat penghantar yang dihubungkan dengan baterai 6 V mengalirkan arus listrik 0,5 A. Jika kawat dipotong menjadi dua bagian sama panjang dan dihubungkan paralel satu sama lain ke baterai maka arus yang mengalir sekarang adalah …
A. 0,25 A B. 0,5 A C. 2A D. 6A E. 12A
9. Pembahasan:

Jawaban: C
(6). Laju Habisnya Sel Bahan Bakar
21. pada sel bahan bakar (fuell cels), arus listrik dihasilkan dari reaksi:
untuk menghasilkan arus tetap sebesar 0,193 A (F = 96500 C/mol e–, sel bahan bakar tersebut menghabiskan H2 dengan laju … ·10-6 g/s
A. 1 B. 2 C. 3 D. 4 E. 5
21. Pembahasan:
Hukum I Faraday:
Massa yang dihasilkan pada sel elektrolisis berbanding lurus dengan muatan listrik dalam sel.

Jawaban: B
(7). Elektrolisis Larutan Natrium Klorida Hasil Gas Cl2 pada Anoda Muatan Listrik
8. Elektrolisis suatu larutan natrium klorida menghasilkan 11,2 liter (STP) gas Cl2 pada anoda. Banyaknya muatan listrik yang lewat adalah …
A. 2,00 F B. 1,50 F C. 1,00 F D. 0,50 F E. 0,25 F
8. Pembahasan:
Elektrolisis larutan NaCl
Hal2 di Katoda, Anoda, mol elektron:
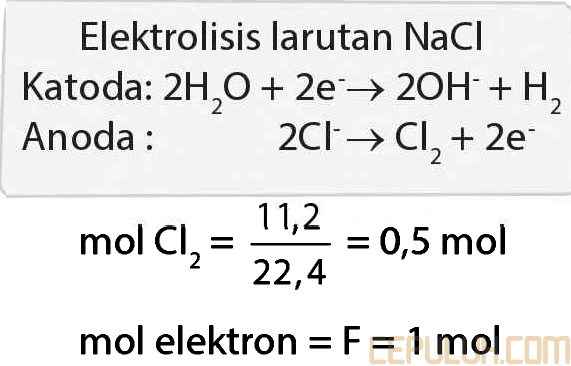
Jawaban: C
(8). Gas Fluorin Sebanyak Liter Stp Muatan Listrik Diperlukan
40. Fluorin dapat diperoleh dari elektrolisis leburan KHF2 sesuai persamaan reaksi:
HF2– ➔ HF + ½F2 + e
untuk menghasilkan gas fluorin sebanyak 2,24 liter (STP), muatan listrik yang diperlukan adalah …
(1 F = 96500 C)
A. 96.500 C B. 19.300 C C. 1.930 C D. 965 C E. 482,5 C
40. Pembahasan:
mol eleltron:
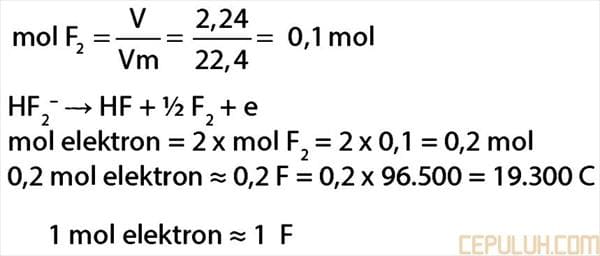
Jawaban: B
(9). Elektrolisis Leburan Garamnya Logam Alkali Dan Logam Alkali Tanah
1. Pembuatan logam alkali dan logam alkali tanah tidak dapat dilakukan dengan cara mengelektrolisis larutan kloridanya.
SEBAB
Logam alkali dan logam alkali tanah adalah reduktor kuat.
1. Pembahasan:
Pembuatan logam alkali dan logam alkali tanah tidakdapatdilakukan dengan cara mengelektrolisis larutan kloridanya. Hal ini disebabkan nilai potensial reduksi standar (E°) logam alkali dan alkali tanah lebih kecil daripada E° air sehingga air yang akan direduksi di katoda. untuk mendapatkan logam alkali dan alkali tanah adalah dengan elektrolisis leburan garamnya.
Jawaban: A
(10). Sel Kering ZnMn Muatan
14. Sel kering bekerja menurut reaksi:
Zn(s) + 2MnO2(s) ➔ ZnMn2O4(s)
untuk menghasilkan muatan sebesar 965 C maka …
(Ar Zn = 65, Mn = 55, O = 16, 1F = 96500 C)
1. Jumlah Zn yang bereaksi adalah 0,325 gram
2. Jumlah MnO2 yang bereaksi adalah 1,10 gram
3. Jumlah ZnMn2O4 yang terbentuk adalah 0,005 mol
4. Dalam sel tersebut MnO2 bertindak sebagai reduktor
14. Pembahasan:

Jawaban: B