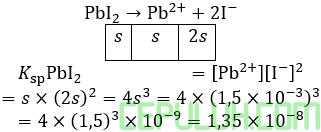(1). Mengapa AgBr paling mudah mengendap?
6. Diketahui:
Ksp AgIO3=4×10-12
Ksp Mn(OH)2=1,9×10-13
Ksp AgBr=5×10-13
Ksp Mg(OH)2=1,2×10-12
dari data di atas, senyawa yang paling mudah mengendap ketika dilarutkan dalam air adalah …
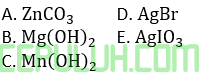
Jawab: D
Senyawa yang paling mudah mengendap adalah susah larut atau kelarutan (s) kecil.
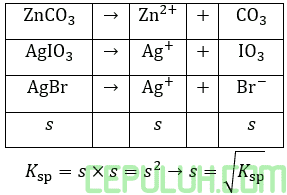
Karena rumus kelarutan (s) serupa maka kelarutan terkecil, jika Ksp terkecil antara ketiganya, yaitu AgBr.
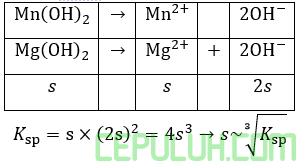
Karena rumus kelarutan (s) serupa maka kelarutan terkecil, jika Ksp terkecil antara ketiganya, yaitu Mn(OH)2.
Hitunglah kelarutan AgBr dan Mn(OH)2 secara kasar untuk mengatahui yang lebih kecil sehingga menjadi senyawa yang paling mudah mengendap antara kelimanya.
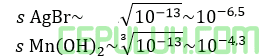
AgBr paling mudah mengendap ketika dilarutkan dalam air.
(2). garam yang mengendap
4. Diketahui:
Ksp SrC2O4=5,6×10-8
Ksp BaC2O4=1,1×10-7
Dalam satu liter larutan yang mengandung garam-garam CaCl2,SrCl2 dan BaCl; dengan konsentrasi sama yakni 0,01 M ditambahkan 67 mg Na2C2O4. Maka garam yang mengendap adalah …. (Mr Na2C2O4=134)
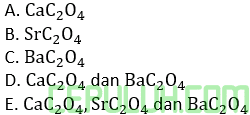
Jawab: E Bahas:
Karena biloks setiap kation sama X2+ maka mol, konsentrasi sama. Konsentrasi setelah pencampuran. Volume tidak berubah atau perubahan diabaikan karena volume Na2C2O4 padat sangat kecil dibanding volume larutan.
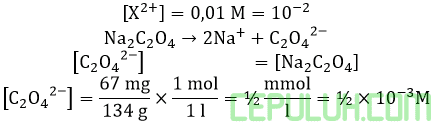
Rumus Qc serupa dan sama besar.
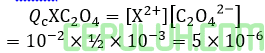
Ada endapan ketiganya karena memiliki Qc > Ksp. Ingat pangkat (–) bilangan asli lebih kecil menyebabkan bilangan real lebih besar.
(3). Keempat zat ini ada endapan
1. Kedalam 1 liter larutan yang mengandung ion Pb2+,Fe2+,Cu2+ dan Cd2+ dengan konsentrasi masing–masing 10-4M ditambahkan 1 liter larutan Natrium Sulfida 10-4M. Maka larutan yang bisa mengendap adalah ….
Diketahui Ksp
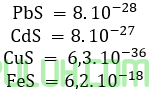
A. PbS,CuS,CdS,dan FeS
B. PbS,CuS,dan CdS
C. PbS dan CuS
D. CdS dan FeS
E. Hanya FeS
Jawab: A Bahas:
Karena biloks setiap kation sama X2+ maka mol, konsentrasi sama. Konsentrasi setelah pencampuran.
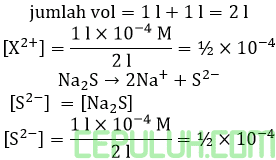
Rumus Qc serupa dan sama besar.
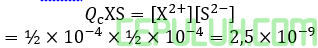
Keempatnya mengendap karena memiliki Qc > Ksp. Ingat pangkat (–) bilangan asli lebih kecil menyebabkan bilangan real lebih besar.
(4). Terbentuk Endapan Karena KSP
Sebanyak 100 mL AgNO3 0,01 M dicampur dengan 100 mL H2SO4 0,01 M. Diketahui
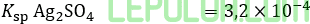
Pernyataan yang benar mengenai campuran tersebut adalah ….
A. terbentuk endapan karena Ksp < Qc
B. terbentuk endapan karena Ksp > Qc
C. belum terbentuk endapan karena Ksp < Qc
D. belum terbentuk endapan karena Ksp > Qc
E. Iarutan tepat jenuh karena Ksp=Qc
Jawab: D Bahas:

Belum terbentuk endapan.
(5). Larutan Ca(NO3)2 KSP Na2CO3 Massa Mengendap Gram
51. Sebanyak 50ml larutan Ca(NO3)2 10-2M dicampurkan dengan 50 ml larutan Na2CO3 10-2 M dengan reaksi:
Ca(NO3)2(aq) + Na2CO3(aq) ➔ CaCO3(s) + 2NaNO3(aq)
Jika KSP Na2CO3 = 9×10-9. Massa yang mengendap sebanyak … gram
(Ar Ca = 40; C = 12; O = 16; Na = 23; N; 14)
A. 100 B. 0,100 C. 0,050 D. 0,025 E. 0,0025
51. Pembahasan:

Jawaban: C
(6). Massa Endapan PbSO4
3. Sebanyak 100 ml larutan Pb(NO3)2 0,4 M dicampurkan dengan 100 ml larutan K2 SO4 0,4 M. Jika Ksp PbSO4=4.10-8 massa PbSO4 yang mengendap sebanyak … gram.(Ar S=32,Pb=207,O=16)
A. 12,12 C. 30,30 E. 303
B. 24,24 D. 60,60
Jawab: A Bahas:
Asumsikan Qc > Ksp tanpa perlu dibuktikan melalui perhitungan dulu. Asumsikan kelarutan PbSO4 dalam Pb(NO3)2 dan kelarutan PbSO4 dalam K2SO4 jauh lebih kecil dari pada massa endapan sehingga massa endapan dapat dihitung dengan cara klasik.

(7). Massa Endapan CaCO3
4. Larutan CaCl2 0,1 M sebanyak 50 ml ditambahkan dalam 50 ml larutan Na2CO3 0,1 M. Massa endapan CaCO3 yang terjadi adalah … gram (Ar Ca = 40,C = 12,O=16,Ksp CaCO3=1.10-10 ).
A. 0,25 C. 0,75 E. 1,50
B. 0,50 D. 1,00
Jawab: B Bahas:
Asumsikan Qc > Ksp tanpa perlu dibuktikan melalui perhitungan dulu. Asumsikan kelarutan CaCO3 dalam CaCl2 dan kelarutan CaCO3 dalam Na2CO3 jauh lebih kecil dari pada massa endapan sehingga massa endapan dapat dihitung dengan cara klasik.
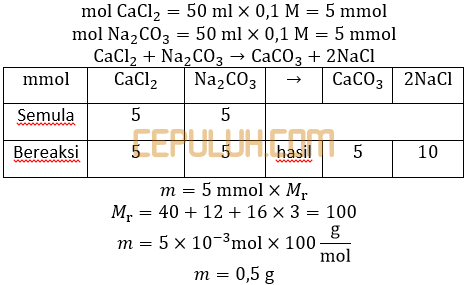
(8). Larutan Jenuh dan Endapan
7. Sebanyak 100 mL AgNO3 0,01 M dicampur dengan 100 mL H2 SO4 0,01 M. Diketahui
Ksp Ag2 SO4=3,2×10-4
Pernyataan yang benar mengenai campuran tersebut adalah ….
A. terbentuk endapan karena Ksp < Qc
B. terbentuk endapan karena Ksp > Qc
C. belum terbentuk endapan karena Ksp < Qc
D. belum terbentuk endapan karena Ksp > Qc
E. Iarutan tepat jenuh karena Ksp=Qc
Jawab: D Bahas:
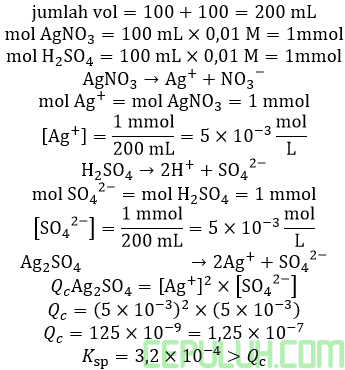
(9). Massa Endapan MgCO3
1. Sebanyak 100 ml larutan MgCl2 0,4 M ditambahkan ke dalam 100 ml larutan Na2CO3 0,4 M. Besarnya massa zat yang mengendap jika diketahui Ksp MgCO3=3.10-8 dan Ar Mg=24,C=12 dan O=16 adalah … gram.
A. 1,68 C. 6,72 E. 84,00
B. 3,36 D. 8,40
Jawab: B Bahas:
Asumsikan Qc > Ksp tanpa perlu dibuktikan melalui perhitungan dulu. Asumsikan kelarutan MgCO3 dalam MgCl2 dan kelarutan MgCO3 dalam Na2CO3 jauh lebih kecil dari pada massa endapan sehingga massa endapan dapat dihitung dengan cara klasik.
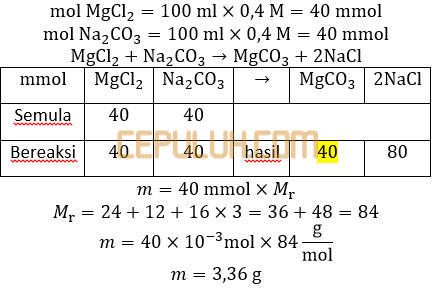
(10). Massa Endapan Ag2 CrO4
2. Ke dalam 100 ml larutan CaCrO4 0,4 M ditambahkan 100 ml larutan AgNO3 0,4 M, jika Ksp Ag2 CrO4=9.10-12, massa zat yang mengendap adalah … gram (Ar Cr=52,Ag=108,N=14).
A. 3,32 C. 13,28 E. 33,20
B. 6,64 D. 16,60
Jawab: B Bahas:
Asumsikan Qc > Ksp tanpa perlu dibuktikan melalui perhitungan dulu. Asumsikan kelarutan Ag2CrO4 dalam AgNO3 dan kelarutan Ag2CrO4 dalam CaCrO4 jauh lebih kecil dari pada massa endapan sehingga massa endapan dapat dihitung dengan cara klasik.

Kelarutan KSP # Hasil Kali Kelarutan KSP
Kelarutan KSP Endapan