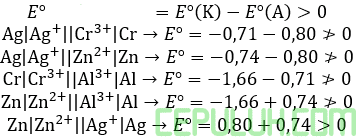(1). Diagram Sel yang dapat Berlangsung Spontan
33. Perhatikan potensial elektrode standar berikut!

Diagram sel yang dapat berlangsung spontan adalah ….

Jawab: E Bahas:
Aturan penulisan anode || katode, supaya spontan harus memenuhi

Arus Listrik #CT# –>
(2). Elektrolisis
34. Perhatikan reaksi elektrolisis berikut ini!
(1) Elektrolisis larutan NaCl dengan elektroda C
(2) Elektrolisis larutan K2SO4dengan elektroda C
(3) Elektrolisis leburan CaCl2dengan elektroda Pt
(4) Elektrolisis leburan CuCl2dengan elektroda C
Reaksi yang sama terjadi di katoda terdapat pada reaksi nomor ….
Jawab: A Bahas:
Elektrolisis larutan di katoda sama, air yang direduksi.

Karena potensial air lebih tinggi dari golongan IA, IIA, IIIA {Na+,K+,}
Elektrolisis leburan melibatkan raksi redoks sederhana karena berlangsung tanpa air. Elektrolisis leburan mengandung logam IA, IIA, IIA dan beberapa transisi oleh elektrode inert C, Pt. Ion-ion logam tersebut akan tereduksi menghasilkan logam-logam tersebut.
(3). Data Potensial Reduksi Standar Ion-Ion Logam Reaksi Berlangsung Keadaan Standar
16. Berikut ini diberikan data potensial reduksi standar ion-ion logam:
Fe2+ + 2e ➔ Fe E° = -0,44 V
Pb2+ + 2e ➔ Pb E° = -0,13 V
Sn2+ + 2e ➔ Sn E° = -0,14 V
Zn2+ + 2e ➔ Zn E° = -0,76 V
Berdasarkan data tersebut, reaksi yang dapat berlangsung dalam keadaan standar adalah …
(1) Fe2+ + Zn ➔ Fe + Zn2+
(2) Pb2+ + Fe ➔ Pb + Fe2+
(3) Sn2+ + Zn ➔ Sn + Zn2+
(4) Zn2+ + Pb ➔ Zn + Pb2+
16. Pembahasan:
Reaksi dapat berlangsung dalam keadaan standar jika E° sel positif.

Jawaban: A
(4). Notasi Sel @ Reaksi Spontan
26. Perhatikan reaksi setengah sel berikut:
Mg2+ + 2e ➔ Mg E° = – 2,37 Volt
Pb2+ + 2e ➔ Pb E° = -0,13Volt
Cu2+ + 2e ➔ Cu E° = +0,34 Volt
Mn2+ + 2e ➔ Mn E° = – 1,18 Volt
Notasi sel yang menunjukkan reaksi spontan adalah …
A. Cu/Cu2+//Mg2+/Mg
B. Mn/Mn2+//Mg2+/Mg
C. Mg/Mg2+//Pb2+/Pb
D. Pb/Pb2+//Mn2+/Mn
E. Cu/Cu2+// Pb/Pb2+
26. Pembahasan:
Urutan mulai dari E° paling kecil:
Mg ➔ Mn ➔ Pb ➔ Cu
Reaksi spontan yaitu reaksi yang menunjukkan E° sel bernilai positif, artinya unsur di sebelah kiri mengalami oksidasi dan unsur di sebelah kanan mengalami reduksi.
Notasi sel yang menunjukkan reaksi spontan, yaitu antara unsur Mg dengan Pb, di mana Mg mengalami oksidasi dan Pb mengalami reduksi.
Mg/Mg2+ // Pb2+/Pb
(oksidasi) // (reduksi)
Jawaban: C
(5). Potensial Reduksi Standar Berlangsung Spontan
19. Diketahui potensial reduksi standar sebagai berikut:
Fe2+ | Fe E° = -0,41 V
Zn2+ | Zn E° = -0,76 V
Cu2+ | Cu E° = +0,34V
Ag+ | Ag E° = +0,80V
Reaksi yang tidak dapat berlangsung spontan adalah …
A. Fe | Fe2+ || Zn2+ | Zn
B. Zn | Zn2+ || Cu2+ | Cu
C. Fe | Fe2+ || Cu2+ | Cu
D. Cu | Cu2+ || Ag+ | Ag
E. Fe | Fe2+ || Ag+ | Ag
19. Pembahasan:
Harga E° kecil ➔ mudah teroksidasi (anoda)
Harga E° besar ➔ mudah tereduksi (katoda)

Reaksi yang berlangsung tidak spontan adalah (A).
Jawaban: A
(6). Diagram Sel Elektrokimia
25. Perhatikan sel elektrokimia berikut!

Penulisan diagram yang tepat dari gambar adalah …
A. Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
B. Cu(s) | Cu2+(aq) || Zn2+(aq) | Zn(s)
C. Zn2+(aq) | Zn(s) || Cu(s) | Cu2+(aq)
D. Cu2+(aq) | Cu(s) || Zn2+(aq) | Zn(s)
E. Zn(s) | Zn2+(aq) || Cu(s) | Cu2+(aq)
25. Pembahasan:
Dalam sel volta:
KaRed ➔ katoda (+) reduksi
AnOks ➔ anoda (-) oksidasi
Diagram sel:
A|An+ || Bm+|B
anoda || katoda
dari gambar terlihat bahwa:
Zn ➔ sebagai anoda
Cu sebagai katoda
Sehingga diagram selnya Zn|Zn2+ || Cu2+|Cu
Jawaban: A
(7). Sel Elektrokimia @ Reaksi di Anoda dan Reaksi di Katoda
14. Perhatikan data persamaan reaksi berikut ini!
Al3+(aq) + 3e– ➔ Al(s) E° = -1,66 volt
Zn2+(aq) + 2e– ➔ Zn(s) E° = -0,76 volt
Notasi sel reaksi yang dapat berlangsung adalah …
A. Zn | Zn2+ || Al3+ | Al
B. Al3+ | Al || Zn | Zn2+
C. Al | Al3+ || Zn2+ | Zn
D. Zn2+ | Zn || Al3+ | Al
E. Al | Al3+ || Zn | Zn2+
14. Pembahasan:
Diagram sel:
A|An+ || Bm+|B
anoda || katoda
Reaksi yang terjadi di anoda memiliki nilai E° lebih negatif dibanding reaksi yang terjadi di katoda sehingga:
Al ➔ mengalami reaksi di anoda
Zn ➔ mengalami reaksi di katoda
Sehingga notasi selnya: Al|Al3+ || Zn2+|Zn
Jawaban: C
(8). Potensial Reduksi Standar Berlangsung Spontan
20. Diketahui potensial reduksi standar sebagai berikut:
Cr3+(aq) + 3e ➔ Cr(s) E°= -0,71 V
Al3+(aq) + 3e ➔ Al(s) E°= -1,66 V
Ag+(aq) + e ➔ Ag(s) E°= +0,80 V
Pt2+(aq) + 2e ➔ Pt(s) E°= +1,50V
Di antara reaksi-reaksi berikut yang dapat berlangsung spontan adalah:
1) Cr3+(aq) + Pt(s) ➔ Cr(s) + Pt2+(aq)
2) Al3+(aq) + Cr(s) ➔ Al(s) + Cr3+(aq)
3) Pt(s) + Ag+(aq) ➔ Pt2+(aq) + Ag(s)
4) Ag+ aq) + Al(s) ➔ Ag(s) + Al3+(aq)
20. Pembahasan:
Reaksi berlangsung spontan jika Esel > 0.

Jawaban: D
(9). Diagram Sel
24. Perhatikan gambar berikut!

Diagram sel yang tepat untuk sel tersebut adalah …
A. Al | Al3+ || Ni2+ | Ni D. Ni | Ni3+ || Al3+ | Al
B. Al 3+ | Al || Ni2+ | Ni E. Ni2+ | Ni || Al | Al3+
C. Al | Al3+ || Ni | Ni3+
24. Pembahasan:

Notasi tersebut menyatakan bahwa di anoda terjadi oksidasi Al menjadi ion Al3+, sedangkan di katoda terjadi reduksi ion Ni2+ menjadi Ni.
Jawaban: A
(10). Potensial Standar Reaksi Berlangsung Spontan Bertindak Sebagai Reduktor
21. Diketahui:
E° Al3+ | Al = -1,68V
E° H+ | H2 = +0,00V
pada keadaan standar, pernyataan yang benar untuk reaksi:
2Al(s) + 6H+(aq) ➔ 2Al3+(aq) + 3H2(g) adalah …
(1) Aluminium bertindak sebagai reduktor
(2) Reaksi berlangsung spontan
(3) Reaksi melibatkan 6 elektron
(4) Potensial standar reaksi adalah +3,36 V
21. Pembahasan:

Jawaban: A
(11). Potensial Reduksi Standar Potensial Sel Galvani
17. Diketahui potensial reduksi standar berikut:
Cr3+(aq) + 3e– ➔ Cr(s) E° = -0,74 V
MnO4–(aq) + 8H+ + 5e– ➔ Mn2+(aq) + 4H2O E° = +1,51 V
Potensial sel standar dari sel Galvani yang dibuat dengan menggabungkan kedua setengah reaksi di atas adalah …
A. -2,25 V D. +2,25 V
B. -0,75 V E. +3,25 V
C. +0,75 V
17. Pembahasan:

Jawaban: D
Elektrokimia # Elektrolisis Faraday Endapan Arus Listrik
Elektrokimia # Diagram Sel Berlangsung Spontan