(1). Tetapan Laju Reaksi
Kalium iodida dioksidasi oleh natrium hipoklorit menjadi kalium hipoiodit dalam larutan basa menurut persamaan reaksi berikut.

Berdasarkan percobaan diperoleh hubungan konsentrasi dan laju reaksi sebagai berikut
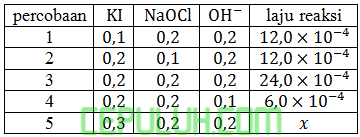
Nilai tetapan laju reaksinya adalah ….
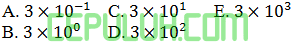
Jawab: B Pembahasan:
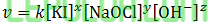
untuk mencari orde [KI], pilih [NaOCl] sama dan [OH–] sama. Pilih reaksi 3 dan 1.

untuk mencari orde [NaOCl], pilih [KI] sama dan [OH–] sama. Pilih reaksi 3 dan 1.
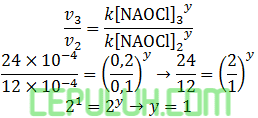
untuk mencari orde [OH–], pilih [KI] sama dan [NAOCl] sama. Pilih reaksi 3 dan 4.

Masukan data yang mudah dihitung, pilih no 1:

(2). Tetapan Laju Reaksi
Soal Pembahasan 1 Menghitung Tetapan Laju Reaksi
dari reaks A+B→C diperoleh data sebagai berikut:

Pernyataan berikut benar, kecuali ….
A. tingkat reaksi terhadap A adalah 1
B. tingkat reaksi terhadap B adalah 2
C. tingkat reaksi total adalah 3
D. tetapan reaksinya adalah 4×10-3
E. tetapan reaksinya adalah 4×10-3
Jawaban: D Pembahasan:
untuk mencari orde [A], pilih konsentrasi [B] sama. Pilih reaksi atas (1) dan tengah (2).

Tingkat reaksi, orde [A] sama dengan x=1.
untuk mencari orde [B], pilih konsentrasi [A] sama. Pilih reaksi bawah (3) dan atas (1).

Tingkat reaksi, orde [B] sama dengan y=2
Tingkat reaksi totalnya x+y=1+2=3.

Tetapan laju reaksinya dilambangkan k. Pilih reaksi atas (1):
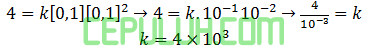
(3). Konstanta Laju Reaksi
Laju reaksi persamaan:
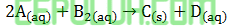
Diketahui lama waktu reaksi untuk membentuk sejumlah endapan C.
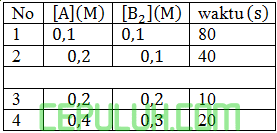
Nilai tetapan laju reaksinya adalah ….
A. 0,125 C. 1,25 E. 0,0125
B. 12,5 D. 125
Jawab: B Pembahasan:

waktu (t) berbanding terbalik dari laju.
untuk mencari orde [A], pilih konsentrasi [B2] sama. Pilih reaksi 2 dan 1.
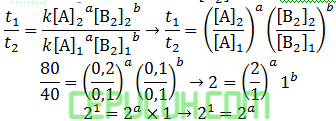
Orde reaksi [A] a=1.
untuk mencari orde [B2], pilih konsentrasi [A] sama. Pilih reaksi 3 dan 2.

Orde reaksi [B2] b=2

Masukan data yang mudah, pilih no 1 untuk menghitung tetapannya:
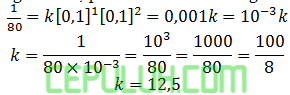
(4). Tetapan Laju Reaksi
Diketahui data percobaan:
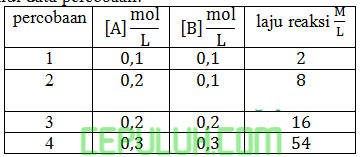
Tetapan laju reaksinya adalah ….

Jawab: E Pembahasan:
untuk mencari orde [A], pilih konsentrasi [B] sama. Pilih reaksi 2 dan 1.
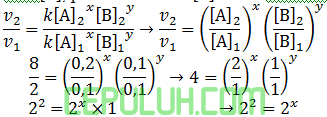
Tingkat reaksi, Orde [A] sama dengan x=2.
untuk mencari orde [B], pilih konsentrasi [A] sama. Pilih reaksi 3 dan 2.
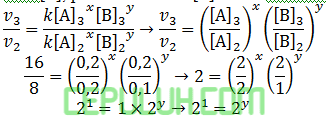
Tingkat reaksi, orde [B] sama dengan y=1
Pilih percobaan 1:

(5). Konstanta Laju Reaksi
pada suatu reaksi X(g)+3Y(g)→XY3(g) diperoleh data percobaan sebagai berikut:
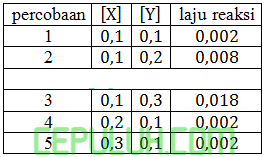
Nilai tetapan laju reaksinya adalah ….
A. 0,0002 C. 0,02 E. 2
B. 0,002 D. 0,2
Jawab: D Pembahasan:
untuk mencari orde [X], pilih konsentrasi [Y] sama. Pilih reaksi 2 dan 1.

Orde [X] sama dengan x=0.
untuk mencari orde [Y], pilih konsentrasi [X] sama. Pilih reaksi 4 dan 1.
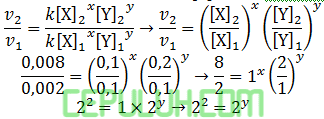
Orde [Y] sama dengan y=2.
Pilih percobaan 1 mudah dihitung:

(6). Harga Tetapan Laju Reaksi
17. pada penentuan laju reaksi, 3X2 + Y2 ➔ 2X3Y,
diperoleh data sebagai berikut:
| [X2](M) | [Y2](M) | v (M/det) |
|---|---|---|
| 0,1 | 0,1 | 0,02 |
| 0,1 | 0,2 | 0,04 |
| 0,3 | 0,2 | 0,36 |
dari data di atas diperoleh harga tetapan laju reaksi, k = … M-2·det-1
A. 200 B. 160 C. 80 D. 20 E. 16
17. Pembahasan:
Orde reaksi X2 (persamaan 2 dan 3):
Orde reaksi Y2 (persamaan 1 dan 2):

untuk mengetahui nilai k substitusikan salah satu persamaan
persamaan (1) ➔ 0,02 = k (0,1 )2·(0,1) ➔ k = 20 M-2·det-1
Jawaban: D
(7). Harga Tetapan Laju Reaksi
10. Percobaan penentuan laju reaksi:
2H2(g) + 2NO(g) ➔ 2H2O(g) + N2(g)
memberikan data sebagai berikut.
| Percobaan ke- | [H2](mol·L-1) | [NO](mol·L-1) | Laju awal (v)(mol·L-1·s-1) |
|---|---|---|---|
| 1 | 0,01 | 0,02 | 32 |
| 2 | 0,02 | 0,02 | 64 |
| 3 | 0,02 | 0,04 | 256 |
Harga tetapan laju reaksi (mol-2L-2S-1) dari reaksi tersebut adalah …
A. 4·104 B. 2·106 C. 4·106 D. 8·106 E. 4·107
10. Pembahasan:
Orde reaksi terhadap H2= x Nomor 1 dan 2:

Jawaban: D
(8). Laju Reaksi @ Tetapan Laju
20. Reaksi oksidasi SO2 yang dikatalisis oleh NO2 merupakan reaksi orde 1 terhadap NO2.
Jika tetapan laju reaksi (k) dengan NO2 adalah 300 kali tetapan laju tanpa NO2 maka [NO2] yang diperlukan agar reaksi menjadi 15 kali laju reaksi tanpa NO2 adalah … M
A. 0,01 B. 0,05 C. 0,10 D. 0,15 E. 0,20
20. Pembahasan:
Reaksi: 2SO2(g) + O2(g) ➔ 2SO3(g)
Reaksi oksidasi SO2 yang dikatalis NO2 merupakan reaksi orde 1 terhadap NO2.
Tetapan laju reaksi (k) dengan NO2 = 300 k tanpa NO2^misal:[NO2] = 1 M.
k dengan NO2 = 15 k tanpa NO2 ➔ [NO2] =(15/300)·1M = 0,05M
Jawaban: B
(9). Tetapan Laju Reaksi
12. Manakah satu di antara pernyataan berikut yang tidak benar tentang tetapan laju reaksi (k)?
A. nilainya bertambah jika digunakan katalisator
B. nilainya bertambah jika energi aktivasi makin besar
C. nilainya tidak berubah meskipun konsentrasi pereaksi diperbesar
D. satuannya bergantung pada orde reaksinya
E. nilainya bertambah jika suhu dinaikkan
12. Pembahasan:
Nilai tetapan laju reaksi (k) sebanding dengan besar laju reaksi.
Energi aktivasi makin besar reaksi berjalan semakin lambat.
Jawaban: B
Laju Reaksi # Orde Total Tingkat
Laju Reaksi # Lama Waktu Reaksi
Rumus Persamaan Laju Reaksi
Laju Reaksi # Laju Kecepatan
Laju Reaksi # Konstanta Tetapan








