(1). Tabel Sistem Periodik Konfigurasi Elektron Unsur
9. Perhatikan tabel sistem periodik unsur berikut!
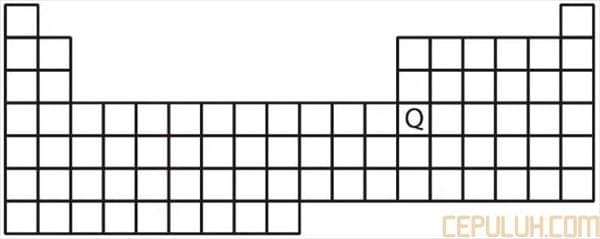
Konfigurasi elektron unsur Q yang paling sesuai adalah …
A. 1s2 2s2 2p6 3s2 3p6 3d10 4p3
B. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
C. 1s2 2s2 2p6 3s2 3p6 4s2 4p6 5s2 5p3
D. 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d5
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 5s1
9. Pembahasan:
dari tabel sistem periodik unsur, terlihat bahwa unsur Q terletakdi golongan IIIA, periode 4 sehingga unsur Q memiliki elektron valensi 4s2 4p1.
Konfigurasi elektron unsur Q:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1.
Jawaban: B
(2). Konfigurasi Elektron dan Letak 1 Unsur pada Tabel Periodik, Golongan dan Periode
19. Unsur L dinotasikan sebagai berikut:
2859L
Konfigurasi elektron dan letak unsur L pada tabel periodik, sesuai dengan golongan dan periodenya, secara berturut-turut adalah …
| Konfigurasi Elektron | Golongan | Periode | |
|---|---|---|---|
| A. | [Ar] 4s2 3d8 | VIII B | 4 |
| B. | [Ar] 4s2 4p6 3d2 | VIII B | 3 |
| C. | [Ar] 4s2 3d5 4p3 | V B | 4 |
| D. | [Xe] 6s2 3f3 | Lantanida | 6 |
| E. | [Xe] 6s2 4f3 | Lantanida | 6 |
19. Pembahasan:
Konfigurasi elektron
2859L = [Ar] 3d8 4s2
Periode: 4
Golongan: VIII B
| Elektron terluar golongan transisi X:(n-l)da nsb n = periode; a+b = golongan a+b = 8,9,10 termasuk golongan VIIB |
Jawaban: A
(3). Konfigurasi Elektron Unsur
18. Perhatikan notasi unsur berikut!
2351A
Letak unsur dan konfigurasi elektron yang paling tepat untuk unsur A adalah … (Nomor atom Ar = 18)
| Golongan | Periode | Konfigurasi Elektron | |
|---|---|---|---|
| A | VA | 3 | [Ar] 4s2 3d3 |
| B | VA | 4 | [Ar] 4s1 3d4 |
| C | VB | 3 | [Ar] 4s2 3d3 |
| D | VB | 4 | [Ar] 4s1 3d4 |
| E | VB | 4 | [Ar] 4s2 3d3 |
18. Pembahasan:
Konfigurasi elektron unsur 23A:

Unsur A terletak pada golongan VB dan periode 4, serta memiliki konfigurasi elektron : [Ar] 4s2 3d3.
Jawaban: E
(4). Konfigurasi Elektron Ion Diketahui Bilangan Massa dan Banyaknya Neutron
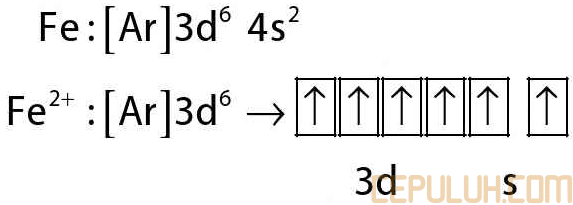
5. Konfigurasi elektron ion X2+ yang memiliki bilangan massa 45 dan 24 neutron adalah
A. Is2 2s2 2p6 3s2 3p6 4s2 3d1
B. Is2 2s2 2p6 3s2 3p6 4s1
C. Is2 2s2 2p6 3s2 3p6 3d1
D. Is2 2s2 2p6 3s2 3p6 4s2 3d2
E. Is2 2s2 2p6 3s2 3p6 4s2 3d3
5. Pembahasan:
Jumlah elektron = 45-24 = 21
2145X :1s2 2s2 2p6 3s2 3p6 4s2 3d1
X2+ :1s2 2s2 2p6 3s2 3p6 3d1
Jawaban: C
(5). Konfigurasi Elektron dan Ikatan Ion
6. Unsur 29X dan 17Y dapat berikatan secara ion
membentuk senyawa XY2 maka konfigurasi
elektron ion X ketika berikatan adalah …
A. [Ar] 4s2 3d9 D. [Ar] 4s0 3d9
B. [Ar] 4s2 3d7 E. [Ar] 4s1 3d10
C. [Ar] 4s1 3d10
6. Pembahasan:
29X : 1s2 2s2 2p6 3s2 3p6 4s1 3d10
17Y : 1s2 2s2 2p6 3s2 3p5
Unsur X dan Y berikatan ion membentuk senyawa XY2 yang artinya X melepaskan 2 elektron dan Y menangkap 2 elektron sehingga konfigurasi X menjadi:
29X :1s2 2s2 2p6 3s2 3p6 4s0 3d9
Jawaban: D
(6). Ion Bermuatan Konfigurasi Elektron Dalam Sistem Tabel Periodik Unsur
12. Ion bermuatan X2+ mempunyai konfigurasi elektron
Is2 2s2 2p6 3s2 3p6 3d4. Unsur tersebut dalam sistem
tabel periodik unsur terdapat pada …
A. golongan VIIIB, periode 4
B. golongan VIA, periode 3
C. golongan VIB, periode 4
D. golongan IVA, periode 3
E. golongan IVB, periode 3
12. Pembahasan:
Unsur X menangkap 2 elektron sehingga konfigurasi X:

Jawaban: C
(7). Konfigurasi Elektron
28. Ion M2+ mempunyai konfigurasi elektron
1s2 2s2 2p6 3s2 3p6 3d6
Oleh karena itu, unsur M …
1. Dalam inti atomnya terdapat 26 proton
2. Dalam sistem periodik terletak pada periode empat
3. Merupakan anggota unsur-unsur transisi
4. dapat membentuk oksida dengan rumus M2O3
28. Pembahasan:
M2+ = 24 elektron (melepaskan 2 elektron)
M = 24 + 2 = 26 proton
24M = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
periode = 4, golongan VI11B
Golongan VIIIB bilangan oksida maksimum = +8
sehingga M membentuk M2O3.
Jawaban: E
(8). Konfigurasi Elektron dari Ion Dalam Tabel Periodik Unsur
11. Diketahui konfigurasi elektron dari ion X3+: Is2 2s2
2p6 3s2 3p6 3d5 maka unsur tersebut dalam tabel
periodik unsur terdapat pada …
A. golongan VIIIB, periode 4
B. golongan VIA, periode 3
C. golongan VIB, periode 4
D. golongan IVA, periode 3
E. golongan IVB, periode 3
11. Pembahasan:
Unsur X menangkap 3 elektron sehingga konfigurasi X:

Jawaban: A
(9). Konfigurasi Elektron @ Ikatan Rumus Molekul
2. Suatu senyawa dengan rumus molekul XY. Jika konfigurasi elektron atom
X: 1s2 2s2 2p6 3s2 3p6 4s2
dan konfigurasi elektron atom
Y: 1s2 2s2 2p4
maka XY mempunyai ikatan …
A. kovalen polar D. elektrovalen
B. kovalen nonpolar E. logam
C. kovalen koordinasi
2. Pembahasan:
X: 1s2 2s2 2p6 3s2 3p6 4s2 ➔ melepaskan 2e (logam)
Y: 1s2 2s2 2p4 -> menangkap 2e (nonlogam)
ikatan ion (elektrovalen) = logam + nonlogam.
Jawaban: D
(10). Konfigurasi Elektron Atom
7. Unsur X mengandung 15 proton dan 16 neutron
di dalam inti atomnya. Konfigurasi elektron atom X
adalah …
A. [Ne] 3s2 3p3 D. [Ar] 4s2 4p4
B. [Ne] 3s2 3p4 E. [Ar] 4s2 3d10 4p1
C. [Ne] 3s1 3p5
7. Pembahasan:
Ingat!
Nomor massa = p + n
Namor atom = p = e

Jawaban: A
Ikatan Kimia # Konfigurasi Elektron