(1). Soal Bentuk Molekul Senyawa SbCl5 Segitiga Bipiramida
Soal bentuk molekul senyawa SbCl5 (nomor atom Sb=51, elektron valensi atom Sb=5; nomor atom Cl=17, elektron valensi atom Cl=7)
Jawaban: segitiga bipiramida AX5.
Pembahasan:
Konfigurasi elektron atom Sb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3, elektron valensi 5.
Konfigurasi elektron atom Cl:1s2 2s2 2p6 3s2 3p5, elektron valensi 7.
Bentuk molekul senyawa SbCl5 menurut teori VSEPR
Struktur Lewis:

Atom Sb sebagai atom pusat memiliki 5 elektron valensi, semua elektron valensi terlibat dalam ikatan dengan lima atom Cl di sekitarnya, masing-masing membentuk ikatan tunggal (PEI=5) maka atom Sb tidak memiliki pasangan elektron bebas (PEB=0) sehingga SbCl5 diprediksi berbentuk segitiga bipiramida sesuai AX5.
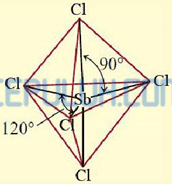
Bentuk molekul senyawa SbCl5 menurut teori hibridisasi
Diagram orbital atom Sb:
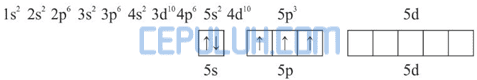
Dalam molekul SbCl5 satu atom Sb mengikat 5 atom Cl. Pengikatan ini dapat berlangsung dengan mengeksitasi 1 elektron dari orbital 5s ke orbital 5d.

Kemudian 5 elektron dari 5 atom Cl memasuki orbital 5s, 5p dan 5d sehingga terbentuk orbital hibrida sp3d.
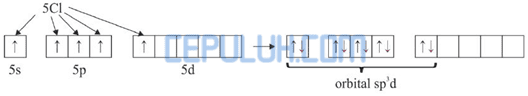
Jadi, molekul SbCl5 diprediksi berbentuk segitiga bipiramida.
(2). Soal Bentuk Molekul Senyawa PCl5 Segitiga Bipiramida
Soal bentuk molekul senyawa PCl5 (nomor atom P=15, elektron valensi atom P=5; nomor atom Cl=17, elektron valensi atom Cl=7)
Jawaban: AX5 berbentuk segitiga bipiramida.
Pembahasan:
Konfigurasi elektron atom P: 1s2 2s2 2p6 3s2 3p3, elektron valensi 5.
Konfigurasi elektron atom Cl: 1s2 2s2 2p6 3s2 3p5, elektron valensi 7.
Bentuk molekul senyawa PCl5 menurut teori VSEPR
Struktur Lewis:

Atom P sebagai atom pusat memiliki 5 elektron valensi, semua elektron valensi terlibat dalam ikatan dengan lima atom Cl di sekitarnya, masing-masing membentuk ikatan tunggal (PEI=5) maka atom P tidak memiliki pasangan elektron bebas (PEB=0) sehingga PCl5 diprediksi berbentuk segitiga bipiramida AX5.
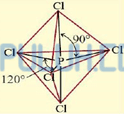
Bentuk molekul senyawa PCl5 menurut teori hibridisasi
Diagram orbital atom P:
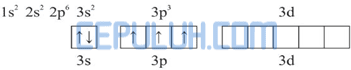
Dalam molekul PCl5, satu atom P mengikat 5 atom Cl. Pengikatan ini dapat berlangsung dengan mengeksitasi 1 elektron dari orbital 3s ke orbital 3d.
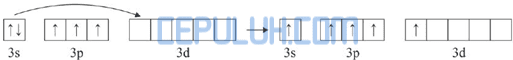
Kemudian 5 elektron dari 5 atom Cl memasuki orbital 3s, 3p dan 3d sehingga terbentuk orbital hibrida sp3d.
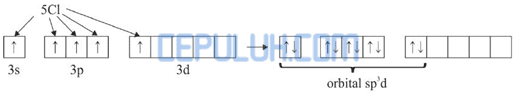
Jadi, molekul PCl5 diprediksi berbentuk segitiga bipiramida.
(3). Rumus Kimia dan Bentuk Molekul Bipiramida Trigonal
8. Konfigurasi elektron dari unsur D dan E.
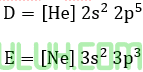
Rumus kimia dan bentuk molekul yang terbentuk jika kedua unsur tersebut berikatan adalah
A. ED, linear
B. ED5, bipiramida trigonal
C. E2 D, linear
D. ED2, planar bentuk V
E. E4 D, tetrahedron
Jawab: B Bahas:
Kecenderungan biloks:
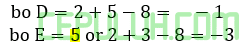
Ikatan yang terbentuk ED5→5+5(-1)=0.
(4). Bentuk Molekul Trigonal Bipiramida
22. Nomor atom P adalah 15, sedangkan Br adalah 35. Bentuk molekul PBr5 adalah …
A. tetrahedral D. trigonal piramida
B. segitiga sama sisi E. bujursangkar
C. trigonal bipiramida
22. Pembahasan:
AX5E0 ➔ trigonal bipiramida.
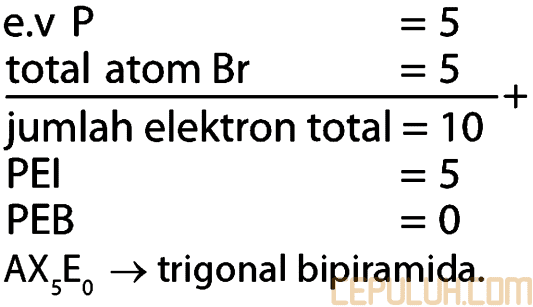
Jawaban: C
Bentuk Molekul Segiempat Piramida
Bentuk Molekul Oktahedral
Bentuk Molekul Tetrahedral Terdistorsi
Bentuk Molekul Segitiga Datar
Bentuk Molekul Linear
Bentuk Molekul Segitiga Piramida
Bentuk Molekul Tetrahedral
Bentuk Molekul Segitiga Bipiramida