(1). Perubahan Entalpi Dua Persamaan Reaksi
Soal Pembahasan 4 Perubahan Entalpi Diketahui Dua Persamaan Reaksi
Diketahui persamaan termokimia berikut:
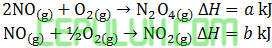
Besarnya ∆H untuk reaksi:
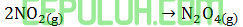
adalah ….kJ.
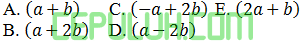
Jawaban: D Pembahasan:
Jika persamaan di balik, sebelah kiri menjadi kanan maka beda entalpi berubah (+) menjadi (–) dan sebaliknya.
Jika koefisien tiap senyawa dikali (k) maka perubahan entalpi dikali (k).
Senyawa yang sama dengan wujud (aq,g,l,s) sama di sebelah sama kiri atau sama kanan kedua persamaan dijumlahkan.
Senyawa yang sama dengan wujud sama di sebelah kiri dan kanan kedua persamaan saling mengurangi.
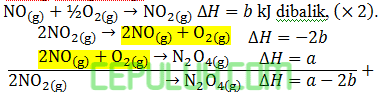
(2). Perubahan Entalpi Diketahui Dua Persamaan Reaksi
Jika diketahui perubahan entalpi untuk reaksi berikut:
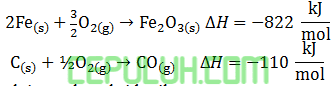
Perubahan entalpi untuk reaksi berikut:
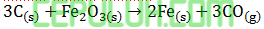
adalah ….
Pembahasan:
Jika persamaan di balik, sebelah kiri menjadi kanan maka beda entalpi berubah (+) menjadi (–) dan sebaliknya.
Jika koefisien tiap senyawa dikali (k) maka perubahan entalpi dikali (k).
Senyawa yang sama dengan wujud (aq,g,l,s) sama di sebelah sama kiri atau sama kanan kedua persamaan dijumlahkan.
Senyawa yang sama dengan wujud sama di sebelah kiri dan kanan kedua persamaan saling mengurangi.
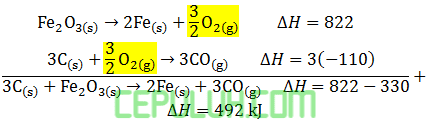
Koefisien mewakili mol.
(3). Konsep Dasar Perubahan Entalpi
Sebanyak 2 mol gas hidrogen jika direaksikan dengan 1 mol gas oksigen akan terbentuk uap air yang melepaskan kalor sebesar 242 kJ. Persamaan termokimianya adalah ….
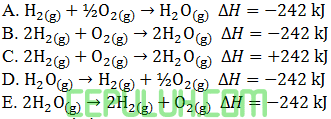
Jawaban: B Pembahasan:
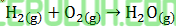
Setarakan banyak atom di kiri-kanan anak panah.
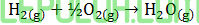
Koefisien tiap senyawa mewakili jumlah mol yang bereaksi. Melepas kalor ∆H=(-)
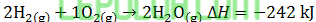
(4). Hukum Hess Perubahan Entalpi Reaksi 1 Mol Etena Menjadi Butena
25. Diketahui reaksi termokimia:
C2H4 + 3O2 ➔ 2CO2 + 2H2O ΔH = a kJ
C4H8 + 6O2 ➔ 4CO2 + 4H2O ΔH = b kJ
Perubahan entalpi untuk reaksi 1 mol etena menjadi butena adalah … kJ
A. (2a-b) B. ½(2a-b) C. -(2a-b) D. -½(2a-b) E. 2(2a-b)
25. Pembahasan:
Jika diketahui lebih dari 1 reaksi maka ΔH ditentukan dengan Hukum Hess.
untuk menentukan reaksi C2H4 ➔ ½C4H8 maka:

Jawaban: B
(5). Perubahan Entalpi Diketahui Dua Persamaan Reaksi
Diketahui dua persamaan reaksi kimia:
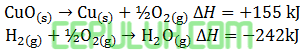
maka perubahan entalpi untuk reaksi:
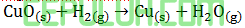
adalah ….
Pembahasan:
Senyawa yang sama dengan wujud (aq,g,l,s) sama di sebelah sama kiri atau sama kanan kedua persamaan dijumlahkan.
Senyawa yang sama dengan wujud sama di sebelah kiri dan kanan kedua persamaan saling mengurangi.
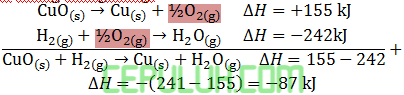
(6). Perubahan Entalpi Reaksi
14. Berdasarkan diagram:

dapat diturunkan perubahan entalpi reaksi: C + 2D ➔ CD2 sebesar …
A. ΔH1 + ΔH2 + ΔH3
B. ΔH1 – ΔH2 + ΔH4
C. -ΔH1 + ΔH2 + ΔH3
D. -ΔH1 + ΔH2 + ΔH4
E. ΔH1 + ΔH2 + ΔH4
14. Pembahasan:
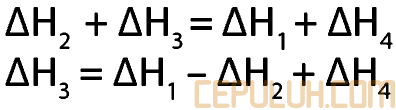
Jawaban: B
(7). Persamaan Termokimia Perubahan Entalpi Reaksi
23. Diketahui persamaan termokimia:
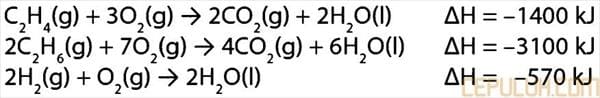
Perubahan entalpi untuk reaksi:
C2H4(g) + H2(g) ➔ C2H6(g) adalah sebesar … kJ
A. -420 B. -270 C. -135 D. +135 E. +420
23. Pembahasan:
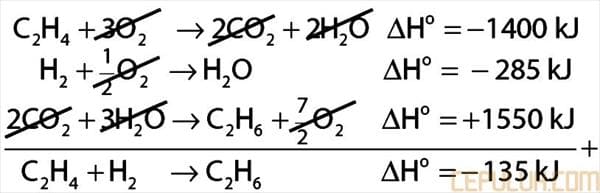
Jawaban: C
(8). Perubahan Entalpi Molar Reaksi Magnesium dan Cuso4
15. Sebanyak 6,0 g serbuk magnesium (Ar Mg = 24) direaksikan dengan larutan CuSO4. Reaksi yang terjadi menimbulkan kenaikkan suhu 11,0°C. Jika diketahui bahwa untuk menaikkan suhu larutan sebesar 1°C diperlukan kalor 6 kJ maka perubahan entalpi molar untuk reaksi:
Mg(s) + Cu(aq) ➔ Mg2+(aq) + Cu(s) adalah … kJ
A. 396 B. 264 C. 66 D. +66 E. +296
15.Pembahasan:
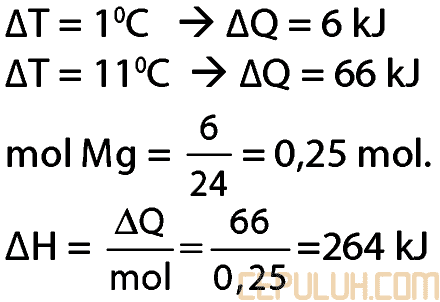
Jawaban: B
(9). Konsep Dasar Perubahan Entalpi
Berikut ini pernyataan yang benar tentang reaksi eksotermis adalah ….
A. kalor pindah dari sistem ke lingkungan, ∆H positif
B. kalor pindah dari lingkungan ke sistem, ∆H negatif
C. kalor pindah dari lingkungan ke sistem, ∆H positif
D. entalpi sistem bertambah, ∆H positif ke-1.com
E. entalpi sistem berkurang, ∆H negatif
Jawaban: E Pembahasan:
Di reaksi eksoterm suhu sistem bertambah (memanas) atau kalor pindah dari sistem ke lingkungan, entalpi sistem turun berkurang ∆H=(-).
Di reaksi endoterm suhu sistem berkurang (mendingin) atau kalor pindah dari lingkungan ke sistem, entalpi sistem naik bertambah ∆H=(+).
(10). Diketahui Persamaan Termokimia No
5. Diketahui persamaan termokimia berikut:
2NO(g) + O2(g) ➔ N2O4(g) ΔH = a kJ
NO(g) + ½O2(g) ➔ NO2(g) ΔH = b kJ
Besarnya ΔH untuk reaksi: 2NO2(g) ➔ N2O4(g) adalah … kJ
A. (a + b) B. (a + 2b) C. (-a + 2b) D. (a-2b) E. (2a + b)
5. Pembahasan:
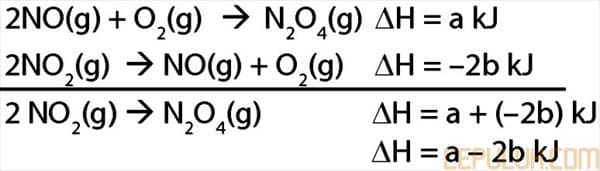
Jawaban: D
Termokimia Entalpi Pembakaran
Termokimia # Energi Ikatan Rata-rata
Termokimia # Perubahan Entalpi