(1). Hubungan Energi Ikat dan Perubahan Entalpi
Diketahui energi ikat rata-rata Ei berikut
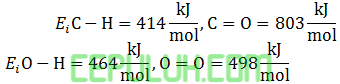
Jika perubahan entalpi pembakaran sempurna ∆Hc C2H2(g) = -1260 kJ/mol maka energi ikatan C≡C adalah ….kJ.
B. 504 D. 1260
Jawaban: C Pembahasan:
Perubahan entalpi pembakaran, jika zat dibakar molekul oksigen. Pembakaran sempurna zat hidrokarbon oleh molekul oksigen menghasilkan karbondioksida dan air.
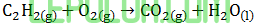
Setarakan banyak atom di kiri dan di kanan panah agar sama.
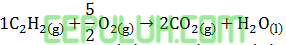
Satuan per mol ∆Hc artinya perubahan entalpi pembakaran standar maka bilangan satu di depan C2H2(g). Atom karbon memberi 4 elektron valensi, hidrogen memberi 2, oksigen menerima 2 elekron. Uraikan garis-garis ikatan dua elekron:
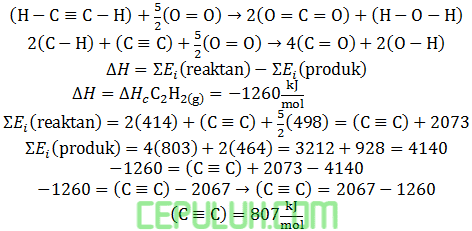
(2). Termokimia Energi Ikatan Isomerisasi Etilen Oksida Menjadi Asetaldehid
35. Persamaan termokimia isomerisasi etilen oksida menjadi asetaldehid adalah
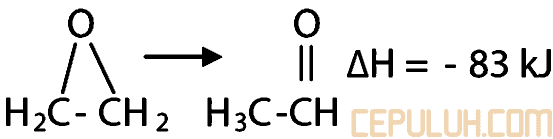
Jika energi ikatan C—O pada etilen oksida adalah 358 kJ/mol maka energi ikatan C=O pada asetaldehid adalah … kJ/mol
A. 83 B. 348 C. 411 D. 799 E. 614
35. Pembahasan:
Jika diketahui harga energi ikatan rata-rata untuk setiap ikatan yang ada da lam suatu reaksi, maka perubahan entalpi reaksinya (ΔH):
ΔH = Σenergi ikatan reaktan (ruas kiri) – Σenergi ikatan produk (ruas kanan)
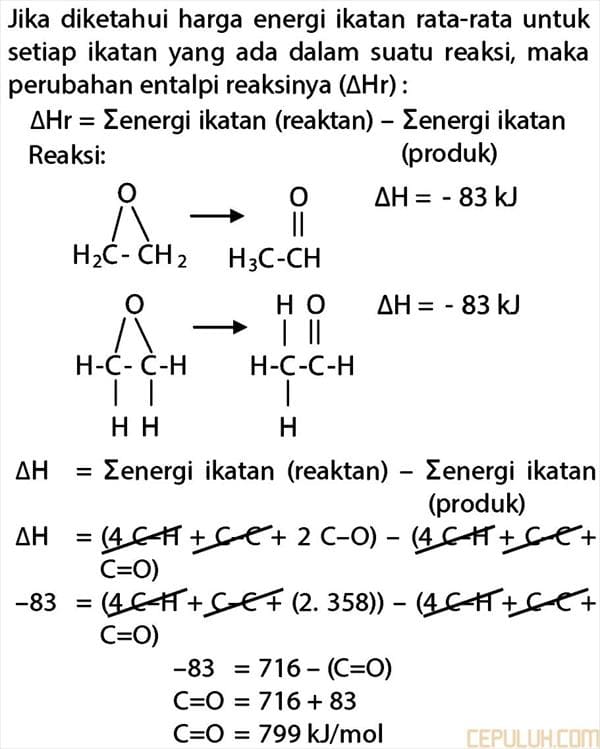
Jawaban: D
(3). Data Energi Ikatan Rata-Rata Entalpi
40. ΔH untuk reaksi H2(g) + Cl2(g) ➔ 2HCl(g), bila diketahui tabelnya adalah … kJ
| Ikatan | Energi ikat (kJ/mol) |
|---|---|
| H—H | 436 |
| Cl—Cl | 243 |
| H—Cl | 431 |
A. 1110 B. 248 C. -183 D. 2838 E. -496
41. Data energi ikatan rata-rata:
C=C : 609 kJ/mol C—C : 345 kJ/mol
C—Cl: 326 kJ/mol H—Cl: 426 kJ/mol
C—H : 412 kJ/mol
Besarnya entalpi reaksi
CH2=CH2 + HCl ➔ CH3CH2Cl adalah …
A. -312 B. -48 C. +48 D. +100 E. +312
41. Pembahasan:
ΔH = Σenergi ikatan reaktan (ruas kiri) – Σenergi ikatan produk (ruas kanan)

Jawaban: B
(4). Daftar Energi Ikatan Perubahan Entalpi Reaksi
39. Diketahui daftar energi ikatan:
| C—C | 347 kJ·mol-1 |
| C=C | 612 kJ·mol-1 |
| C—Cl | 331 kJ·mol-1 |
| C—H | 414 kJ·mol-1 |
| Cl—Cl | 242 kJ·mol-1 |
Perubahan entalpi reaksi:
H2C=CH2(g) + Cl2 ClH2C—CH2Cl(g)
adalah … kJ
A. -254 B. -155 C. +89 D. +177 E. +254
39. Pembahasan:
Penentuan berdasarkan energi ikat:
ΔH = Σenergi ikatan reaktan (ruas kiri) – Σenergi ikatan produk (ruas kanan)

Jawaban: B
(5). Energi Disosiasi Energi Ikatan Rata-Rata Perubahan Entalpi Reaksi
26. Energi disosiasi Cl2(g) dan Br2(g) berturut-turut adalah 240 kJ/mol dan 190 kJ/mol, serta energi ikatan rata-rata H—Cl dan H-Br berturut-turut adalah 428 kJ/mol dan 362 kJ/mol. Bila pada reaksi berikut:
2HBr(g) + Cl2(g) ➔ 2HCl(g) + Br2(g)
dihasilkan 1 mol gas HCl maka perubahan entalpi reaksi yang terlibat adalah … kJ
A. -82 B. -41 C. -16 D. +41 E. +82
26. Pembahasan:
Data energi ikat:

ΔH untuk 1 mol HCl yang dihasilkan = ½·(-82 kJ) = -41 kJ
Jawaban: B
(6). Reaksi Pembentukan Energi Ikat
16. Reaksi pembentukan H2O dari unsur-unsurnya berlangsung sebagai berikut:
Energi pembentukan O(g) dan H(g) masing-masing adalah 248 kJ/mol dan 227 kJ/mol, sedangkan energi ikat O-H adalah 464 kJ/mol. Pernyataan yang benar untuk reaksi tersebut adalah …
(1) Perubahan entalpi reaksi adalah -452 kJ.
(2) Perubahan entalpi pembentukan O2 adalah 248 kJ.
(3) Perubahan entalpi pembentukan standar H2O(g) adalah -226 kJ.
(4) Perubahan entalpi pembentukan H2(g) adalah 870 kJ.
16. Pembahasan:

Jawaban: B
(7). Soal Jawaban 9 Perubahan Entalpi Diketahui Energi Ikatan
Diketahui beberapa energi ikatan:
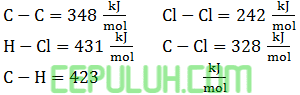
Entalpi reaksi: C3H8(g)+Cl2(g)→C3H7Cl(g)+HCl(g) adalah … kJ/mol.
Jawaban: D Pembahasan:
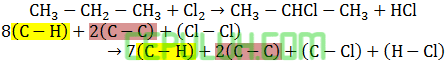
Agar mudah eliminasi dulu ikatan yang sama di kiri-kanan panah.

(8). Soal Jawaban 14 Perubahan Entalpi Diketahui Energi Ikatan
Diketahui energi ikatan rata-rata dari:
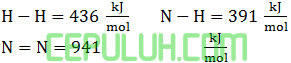
kalor yang diperlukan untuk menguraikan 34 gram NH3 (Mr=17) menjadi unsur-unsur adalah ….
pembahasan:
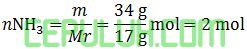
Persamaan penguraian 1 mol NH3 menjadi molekul unsur-unsurnya:
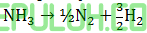
Persamaan penguraian 2 mol NH3, persamaannya (×2):
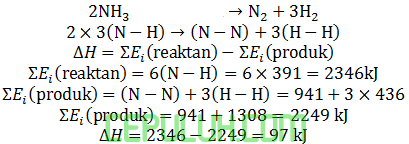
(9). Hubungan Energi Ikat dan Perubahan Entalpi
Perubahan entalpi pembentukan gas ∆Hf HCl(g)=-a kJ/mol; energi ikatan H-H dan Cl-Cl masing-masing b dan c. Besarnya energi ikatan H-Cl pada senyawa adalah ….kJ.
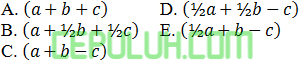
Jawaban: B Pembahasan:
Senyawa yang terbentuk di kanan sebaga produk. Jika satuan per mol berarti pembentukan standar ( ∆Hf°) 1 mol senyawa (HCl(g)).
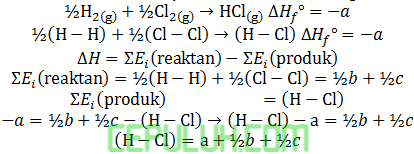
(10). Soal Jawaban 10 Perubahan Entalpi Diketahui Energi Ikatan
Diketahui beberapa energi ikatan:
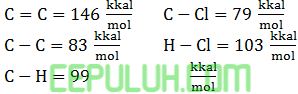
Entalpi reaksi: C2H4(g)+HCl(g)→C2H5Cl(g) adalah … kJ/mol.
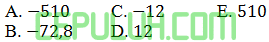
Jawaban: C Pembahasan:
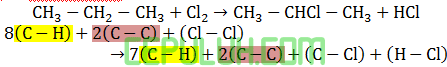
Agar mudah eliminasi dulu ikatan yang sama di kiri-kanan panah.

Termokimia # Energi Ikatan Rata-rata